Wurtzsche Synthese
Die Wurtzsche Synthese (oder Wurtz-Reaktion) ist eine Namensreaktion aus der organischen Chemie, welche 1854 von dem französischen Chemiker Adolphe Wurtz (1817–1884) entdeckt wurde.[1] Sie dient der Synthese von (Cyclo-)Alkanen ausgehend von Halogenalkanen.

Übersichtsreaktion
Bei der Reaktion handelt es sich um eine Kupplung von zwei Halogenalkanen zu symmetrischen Alkanen.[2]
Als Reduktionsmittel wird meist Natrium verwendet. Die Reste R sind Alkylgruppen.
Mechanismus
Die genauen Details des Mechanismus der Reaktion wurden bis jetzt noch nicht aufgeklärt. Es gibt jedoch einen zurzeit anerkannten Mechanismus, der wie folgt verläuft:[3]

Zunächst reagiert das Halogenalkan mit Natrium unter Bildung einer carbanionischen Organometallverbindung. Im zweiten Schritt greift der Alkylrest der metallierten Verbindung als Nukleophil ein weiteres Halogenalkan an. Es findet eine nukleophile Substitution des Halogenids statt.
Die Reaktivität der Halogenalkane nimmt dabei in der Reihenfolge Alkyliodide, Alkylbromide und Alkylchloride ab.[1] Die Triebkraft der Wurtzschen Synthese ist die Bildung eines Natriumhalogenids mit hoher Gitterenergie.[4]
Verwendung
Aufgrund von Nebenreaktionen wie Eliminierungen oder Umlagerungen ist die präparative Nutzung der Wurtzschen-Synthese stark eingeschränkt.
- Ein Beispiel, bei der die Ausbeuten jedoch über 90 % betragen, ist der Aufbau von gespannten Systemen:
 Synthese von Bicyclobutan
Synthese von Bicyclobutan
- Bei der intramolekularen Synthesereaktion von Bicyclobutan aus 1-Brom-3-chlorcyclobutan lassen sich die Nebenreaktionen weitgehend in den Hintergrund drängen.[2]
- Mittels der Wurtzschen-Synthese sind Cycloalkane der Ringgröße von drei bis sechs Kohlenstoffatomen zugänglich:
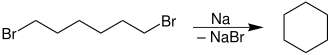 Darstellung von Cycloalkanen
Darstellung von Cycloalkanen
- Hier findet eine weitere intramolekulare Wurtz-Reaktion von 1,n-Dihalogenalkanen (n = 3 – 6) statt, welche von Freund 1882 und Gustavsson 1887 entdeckt wurde.[5]
- Squalen ist ein acylischer Triterpenkohlenwasserstoff, welcher zuerst von Tsyjimoto 1916 aus Lebertran von Haifischen isoliert wurde. Die synthetische Herstellung verläuft mittels der Wurtz-Synthese mit Magnesium:
 Synthetische Herstellung von Squalen
Synthetische Herstellung von Squalen
Siehe auch
Einzelnachweise
- Siegfried Hauptmann: Organische Chemie. 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 204.
- T. Laue, A. Plagens: Namens- und Schlagwortreaktionen der Organischen Chemie. Teubner Verlag, 2006, ISBN 3-8351-0091-2, S. 359–360.
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis. Elsevier Science & Technology Books, 2005, ISBN 0-12-369483-3, S. 498.
- Hans Beyer, Wolfgang Walter: Organische Chemie. S. Hirzel Verlag, Stuttgart 1984, ISBN 3-7776-0406-2, S. 58.
- Siegfried Hauptmann: Organische Chemie. 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 217 f.
- Siegfried Hauptmann: Organische Chemie. 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 695.