Wolframblau
Wolframblau ist eine anorganische chemische Verbindung des Wolframs aus der Gruppe der Oxidhydroxide. Neben H0,5WO3 werden weitere Wolframoxidhydroxide bestimmter Zusammensetzung und mit Oxidationszahlen zwischen 5 und 6 wegen der tiefblauen Farbe ihrer Lösungen[3] als Wolframblau bezeichnet und entsprechen in vielfacher Hinsicht dem Molybdänblau.[4]
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
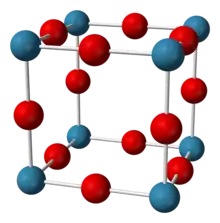 | |||||||
| _ W5,5+ _ O2− Kristallstruktur von H0,5WO3 | |||||||
| Allgemeines | |||||||
| Name | Wolframblau | ||||||
| Verhältnisformel | H0,5WO3 | ||||||
| Kurzbeschreibung |
blauer Feststoff[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 232,42 g·mol−1 | ||||||
| Aggregatzustand |
fest[1] | ||||||
| Dichte |
7,35 g·cm−3[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Gewinnung und Darstellung
Wolframblau H0,5WO3 entsteht durch Einwirkung von Reduktionsmitteln auf Wolfram(VI)-oxid.[1]
Eigenschaften
Wolframblau H0,5WO3 ist ein braunes bis violettes Pulver, das sehr leicht oxidierbar ist. Bei Kontakt mit Wasser oxidiert es unter Wasserstoff-Abgabe. Bei langsamer Oxidation können blaues H0,33WO3 und H0,1WO3 gewonnen werden. H0,5WO3 gibt bei thermischer Zersetzung neben Wasser auch noch Wasserstoff ab. Es besitzt eine Kristallstruktur vom DO9-Typ mit leicht tetragonaler Verzerrung.[1][5]
Verwendung
Wolframblau dient als Nachweis von Wolframaten (z. B. Natriumwolframat) bzw. Wolfram(VI)-Verbindungen[6], aus denen es durch Reduktion entsteht.[4] Früher wurde es auch als Mineralblau bezeichnet und diente Ende des 19. Jahrhunderts als Pigment in der Malerei.[7]
Einzelnachweise
- Georg Brauer: Handbuch der präparativen anorganischen Chemie. 3., umgearb. Auflage. Band 3. Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1566.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Gert Blumenthal, Dietmar Linke, Siegfried Vieth: Chemie: Grundwissen Für Ingenieure. Springer DE, 2006, ISBN 3-8351-9047-4, S. 339 (eingeschränkte Vorschau in der Google-Buchsuche).
- Heinrich Remy: Lehrbuch der Anorganischen Chemie Band II, Akademische Verlagsgesellschaft Geest & Portig Leipzig 1961, S. 218
- Oskar Glemser, Christa Naumann: Kristallisierte Wolframblauverbindungen; Wasserstoffanaloga der Wolframbronzen HxWO3. In: Zeitschrift für anorganische und allgemeine Chemie. 265, 1951, S. 288–302, doi:10.1002/zaac.19512650413.
- Hans Peter Latscha, Helmut Alfons Klein: Analytische Chemie: Chemie-Basiswissen III. Springer DE, 2004, ISBN 3-642-18493-6, S. 88 (eingeschränkte Vorschau in der Google-Buchsuche).
- Georg Schwedt: Chemische Experimente in Schlössern, Klöstern und Museen: Aus Hexenküche und ... John Wiley & Sons, 2012, ISBN 3-527-66132-8, S. 222 (eingeschränkte Vorschau in der Google-Buchsuche).