Latentwärmespeicher
Ein Latentwärmespeicher (auch Phasenwechsel- oder PCM-Speicher) ist ein spezieller Typ von Wärmespeicher, der einen Großteil der ihm zugeführten thermischen Energie in Form von Umwandlungsenthalpie, früher latente Wärme genannt (z. B. für einen Phasenwechsel von fest zu flüssig), speichert. Die gespeicherte Energie ist verborgen (lateinisch latere, „verborgen sein“), da, solange die Phasenumwandlung nicht ganz abgeschlossen ist, die Temperatur eines Stoffes trotz Wärmezufuhr nicht weiter ansteigt. Latentwärmespeicher können daher in einem kleinen Temperaturbereich rund um den Phasenwechsel sehr große Wärmemengen speichern und übertreffen dabei Wärmespeicher, die nur die thermische Energie, früher sensible Wärme genannt, eines Stoffes nutzen, wie etwa Heißwasserspeicher.

Da viele Stoffe mit unterschiedlichsten Schmelzpunkten als Phasenwechselmaterial (engl. phase change material, PCM) in Frage kommen, können viele Speicheranwendungen vom Kälte- bis zum Hochtemperaturwärmespeicher mit dieser Technik abgedeckt werden. Die bekanntesten kommerziellen Anwendungen sind derzeit aber noch Kühlakkus und Wärmekissen.
Funktionsprinzipien
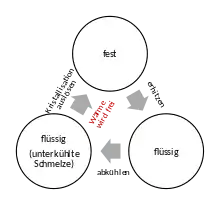
Latentwärmespeicher funktionieren durch die Ausnutzung der Enthalpie thermodynamischer Zustandsänderungen eines Speichermediums. Das dabei am häufigsten genutzte Prinzip ist die Ausnutzung des Phasenübergangs fest-flüssig und umgekehrt (Erstarren-Schmelzen). Prinzipiell kann auch beim „Verdampfen“ und „Kondensation“ von Flüssigkeiten Latentwärme gespeichert werden. Da das Gas jedoch beim Phasenübergang viel Platz benötigt ist die resultierende Energiedichte so gering, dass dies keinen kommerziellen Nutzen hat.
Beim Aufladen des Inhalts kommerzieller Latentwärmespeicher werden meist spezielle Salze oder Paraffine als Speichermedium geschmolzen, optimalerweise soll der Stoff dabei sehr viel Energie (Schmelzenthalpie) aufnehmen, wie z. B. Dinatriumhydrogenphosphat-Dodecahydrat,[1] und dabei wenig Platz benötigen. Das Entladen findet beim Erstarren statt, wobei das Speichermedium die zuvor aufgenommene große Wärmemenge als Kristallisationsenthalpie wieder an die Umgebung abgibt.
Für technische Anwendungen als Latentwärmespeicher ist eine Unterkühlung der Schmelze in der Regel unerwünscht. Daher müssen dem Material geeignete Keimbildner zugesetzt werden, die eine Kristallisation kurz unterhalb der Schmelztemperatur bewirken.
Wärmekissen
In Wärmekissen wird häufig Natriumacetat-Trihydrat verwendet.[2] Es wird bei einer Schmelztemperatur von 58 °C verflüssigt, was meistens durch das Einlegen der Wärmekissen in kochendes Wasser erreicht wird. Beim Erhitzen muss das Kissen andauernd vollständig von Wasser bedeckt sein (Wasserbad), weil sonst lokal besonders heiß werdendes Salz den Beutel schmelzen lässt. Das Material bleibt auch noch bei Temperaturen weit unterhalb des Schmelzpunktes – unter Umständen bis −20 °C – als unterkühlte Schmelze in einem metastabilen Zustand flüssig, da das Salz sich in seinem Kristallwasser löst; die Wassermoleküle bilden eine Art eigenes Kristallgitter, das sich zuerst auflöst. Wird nun ein Metallplättchen (ähnlich dem in einem Knackfrosch) im Wärmekissen gedrückt, löst das die Kristallisation aus. Das Kissen erwärmt sich dabei wieder, jedoch maximal nur auf die Schmelztemperatur. Verbleibt also, nach dem das Kissen „sich selbst“ auf die Schmelztemperatur (58 °C) erwärmt hat, Flüssigkeit im System, kann diese nicht mehr weiter kristallisieren. Es müsste erst Wärme aus dem Kissen abgeführt werden, ansonsten erliegt die interne Kristallisation.
Als Auslöser für die Kristallisation der übersättigten Lösung kommen in Frage:
- die Druckwelle, die durch das Drücken des Metallplättchens ausgelöst wird,
- die dabei verursachte Freisetzung mikroskopisch kleiner Kristallisationskeime, die sich bei jeder Kristallisation in kleinen Ritzen des Metalls festsetzen.[3]
Ein Problem der Erklärung durch die Druckwelle ist, dass die Kristallisation im Experiment durch Schallwellen, selbst durch Ultraschall, nicht ausgelöst wird.[4]
Andere Salzhydrate können ebenfalls verwendet werden, z. B. Glaubersalz mit einem Schmelzpunkt von 32,5 °C, Natriumhydroxid oder Alaun.[5]
Merkmale
Der Vorteil dieser Wärmespeichertechnik beruht darauf, in einem kleinen, durch die Schmelztemperatur des eingesetzten Speichermaterials festgelegten Temperaturbereich viel Wärmeenergie in relativ wenig Masse zu speichern. Beim bloßen Erwärmen des Mediums wird dagegen ein größerer Temperaturbereich benötigt, um vergleichbare Wärmemengen zu speichern.
Beim Wärmekissen wird zusätzlich der metastabile Zustand der unterkühlten Lösung genutzt. So kann ein Großteil der Wärme ohne thermische Isolierung gespeichert werden. Es kommt beim Herunterkühlen trotzdem zu Wärmeverlusten, diese beschränken sich jedoch nur auf die isobare Wärmekapazität der Flüssigkeit.
Es wird ein Teil der Kristallisationsenthalpie zum isobaren Erwärmen der noch im Speicher vorhanden „unterkühlten Flüssigkeit“ verwendet.
Wird also dem Kissen nach dem vollständigen Verflüssigen (Schmelzen des Eises mithilfe einer Wärmequelle oberhalb der Schmelztemperatur) im Anschluss wieder Wärme entzogen, so ergibt sich aufgrund des Kristallisationsverzugs, dass die Temperatur der Flüssigkeit auf Werte unterhalb der Schmelztemperatur erniedrigt werden kann.
Es gilt die Analogie von Eiswasser: Auch hierbei kann die Temperatur des Gemischs nicht dauerhaft erniedrigt werden, so lange sich noch flüssiges Wasser im System befindet. Es bildet sich ständig neues Eis. Analog dazu kann bei Wärmezufuhr die Temperatur nicht erhöht werden, da ständig Eis schmilzt. Es handelt sich also in beiden Fällen um eine isotherme Zustandsänderung.
Auch beim Wärmekissen würde ohne Eintreten des Kristallisationsverzugs beim Versuch, das System abzukühlen, solange noch Flüssigkeit vorhanden ist, immer mehr Flüssigkeit kristallisiert werden. Die freiwerdende Kristallisationsenthalpie hebt die Temperatur des Systems immer wieder auf die Schmelztemperatur an.
Das flüssige Natriumacetat-Trihydrat hat eine spezifische Wärmekapazität von etwa 2,57 kJ/(kg K).[6], die kristalline Phase etwa 4,88 kJ/(kg K).
Bei Unterkühlung der Flüssigkeit von 58 °C auf 20 °C erniedrigt sich damit die innere Energie des Systems gemäß der der Formel ΔU =CP*ΔT um rund 97,66 kJ.
Zum Schmelzen von 1 kg „Feststoff“ wird jedoch etwa 226 kJ benötigt.[7]
Die innere Energie des Systems wird also beim Unterkühlen nicht um das Äquivalent der Schmelzenthalpie erniedrigt. Die Differenz der Wärmemenge wird damit nicht mit der Umgebung ausgetauscht, sondern verbleibt im metastabilen Zustand im System.
Beispiele
Wasser
So wird beispielsweise beim Erstarren bzw. Gefrieren von Wasser – dem Phasenübergang vom flüssigen Wasser zum festen Eis bei 0 °C – ungefähr so viel Wärme frei, wie zum Erwärmen derselben Menge Wasser von 0 °C auf 80 °C benötigt wird. Die spezifische Phasenumwandlungsenthalpie ist also im Vergleich zur spezifischen Wärmekapazität relativ hoch (für Wasser: Schmelzenthalpie 334 kJ/kg, spezifische Wärmekapazität ca. 4,19 kJ/(kg·K)), wodurch die Energiedichte erheblich größer ist als bei Warmwasserspeichern. In Kombination mit einer Wärmepumpe ermöglicht ein Wasser-Latentwärmespeicher die Bereitstellung von Wärme zum Verdampfen des Kältemittels, insbesondere während der Heizperiode. Siehe „Eis Speicher Wärmepumpe“.
Paraffin
Je nach Arbeitsbereich kann auf verschiedene Stoffe zurückgegriffen werden. Soll die Wärmemenge mit einer größeren Temperatur als 0 °C aufgenommen bzw. bereitgestellt werden, ist man auf Stoffe angewiesen, welches bei höheren Temperaturen einen Phasenübergang durchlaufen.
Paraffine haben je nach Sorte eine Schmelztemperatur zwischen 40 °C und 70 °C, außerdem bieten diese eine hohe Schmelzenthalpie. Beispielsweise hat Hartparaffin eine Schmelztemperatur von etwa 60 °C bei einer Schmelzenthalpie zwischen etwa 200 und 240 kJ/kg (Wasser: 333 kJ/kg). Damit ist dieser Stoff als „Latentwärmespeicher“ in diesem Temperaturbereich gut geeignet.[8]
Metalle
Die latente Wärmespeicherung auf Hochtemperatur-Niveau kann beispielsweise in Metallen realisiert werden. Ein Beispiel für ein metallisches Phasenwechselmaterial (englisch metallic Phase Change Material, mPCM) ist eine Aluminium-Silicium-Legierung mit einer Schmelztemperatur von 577 °C. Da der Bereich der nutzbaren Arbeitstemperatur bei der Hochtemperatur-Speicherung größer ist, kann mehr thermische Energie im sensiblen Bereich gespeichert werden. Aber auch die spezifische Schmelzenthalpie ist bei diesem Material mit hoher Schmelztemperatur größer als bei Wasser oder Paraffinen (Aluminium-Silicium: 560 kJ/kg).
Salz
Speicher wirklich großer Kapazität lassen sich nur unterirdisch realisieren. Eine Möglichkeit sind hier Salz-Latentwärmespeicher in natürlichen Salzstrukturen. Wegen der hohen Schmelztemperatur des Salzes eignen sich diese Speicher dann zur Rückverstromung nach dem Prinzip einer Carnot-Batterie.[9]
Chemische Wärmespeicher
Einem ähnlichen Prinzip folgt die Ausnutzung der Enthalpie reversibler chemischer Reaktionen, so zum Beispiel von auf Chemisorption beruhenden Absorptions- und Desorptionsprozessen. Das geschieht in sogenannten thermochemischen Wärmespeichern, die eine noch höhere Energiedichte ermöglichen.
Anwendungen
Moderne Latentwärmespeichermaterialien auf Salz- oder Paraffinbasis haben für verschiedene Anwendungen entwickelte physikalische Eigenschaften und sind für nahezu alle Temperaturbereiche erhältlich. Sie finden Einsatz in Warmhalteplatten für die Gastronomie oder auch in der Heizungs- und Baustoffindustrie als wärmepuffernde Baustoffe. Ein Beispiel für eine häufige Anwendung sind Kühldeckenelemente. Diese werden beispielsweise an einen Wasser Kühlkreislauf angeschlossen und über Strahlungsaustausch wird dem Raum überschüssige Wärme entzogen. Die Kombination mit PCM in der Decke ermöglicht es auf regenerative Kälte zurückzugreifen.
Auch in der Fahrzeugtechnik kommen Latentwärmespeicher auf Salz- oder Paraffinbasis zum Einsatz, um beispielsweise überschüssige Motorwärme zu speichern und diese beim Kaltstart freizusetzen. Aktuell werden darüber hinaus Speichersysteme auf Basis von metallischen Phasenwechselmaterialien (mPCM) für die Anwendung in Elektrofahrzeugen entwickelt. Speichersysteme mit hohen Energiedichten bei gleichzeitig herausragendem thermischem Leistungspotential sollen zukünftig die Heizleistung in Elektrofahrzeugen übernehmen. Hierdurch müsste die zum Heizen benötigte Energie nicht aus der Traktionsbatterie entnommen werden, was notwendige Batteriekapazitäten reduzieren könnte bzw. die Reichweite von Elektrofahrzeugen im Winter erhöhen würde.[10]
Phase change materials (PCM) finden zudem Anwendung in Funktionstextilien. Diese können dadurch die Körper- oder Umgebungswärme aufnehmen, speichern und wieder abgeben. Damit ermöglichen sie das Abpuffern der Temperatur eines „Wohlfühlbereiches“ nach unten wie oben.
Bei Einsatz von Latentwärmespeichern zur Solarwärmespeicherung der Heizenergie für den Winter sind die Investitionen zwar höher, das System spart gegenüber der Nutzung von Wassertanks oder Kies jedoch deutlich Platz und kann wegen der Ausnutzung der Latentwärme gleichmäßiger Wärme abgeben als diese.
Ein Rechenbeispiel soll die Größenordnungen verdeutlichen. Zur Beheizung eines gut gedämmten Hauses mit einem Energiebedarf von 100 kWh/(m²·a) und 89 m² Wohnfläche werden 890 Liter Heizöl oder 890 m³ Erdgas benötigt (siehe den Artikel „Heizwert“). Das entspricht einem Jahres-Wärmebedarf von 32 GJ. Um diese Wärmemenge im Sommer durch Solarabsorber zu erzeugen, werden bei angenommenen 100 Sonnentagen und einem Ertrag von 4 kWh/(m²·d) etwa 23 m² Solarabsorberfläche nötig. Um die durch Solarabsorber im Sommer erzeugte Wärmemenge von 32 GJ für den Winter in Form von Latentwärme zu speichern, werden ca. 200 m³ Paraffin in einem Tank benötigt. Im Jahre 2008 sind einzelne, mit Paraffin gefüllte Kleinbehälter in einem Wassertank üblich. Die 200 m³ entsprechen einem Rundtank mit 8 Meter Höhe und einem Durchmesser von gut 5,6 Meter. Mit den in einen solchen Tank passenden ca. 200 m³ Heizöl könnte das gleiche Haus allerdings 225 Jahre lang beheizt werden.
In der Abfallverwertungsanlage Augsburg wird seit Januar 2013 im Rahmen eines Modellprojektes ein Teil der bei der Verbrennung entstehenden Abwärme in Containern mit Natriumacetat gespeichert. Diese werden dann mit dem LKW ins nahe Friedberg transportiert, wo die Wärme zur Beheizung eines Schulzentrums verwendet wird.[11]
Im Landkreis Landsberg am Lech und Umgebung entsteht seit 2019 das erste Wärmecluster in Deutschland. Unter Cluster versteht man in diesem Fall den Verbund von mehreren Quellen und Senken, welche bisher ungenutzte Abwärme z. B. zum Beheizen von Gebäuden nutzbar macht. Mögliche Wärmequellen sind z. B. Blockheizkraftwerke von Biogasanlagen, Abfallverbrennungsanlagen oder industrielle Prozesse. Mögliche Wärmesenken sind z. B. Wärmenetze, Quartiere, Gewerbegebäude oder Schwimmbäder. Transportiert wird die Wärme mithilfe mehrerer mobiler Latentwärmespeicher, welche von einem LKW zwischen Wärmequelle und Wärmesenke hin und her gefahren werden. Durch die perspektivische Nutzung von elektrischen Zugmaschinen wird das Wärmecluster in den kommenden Jahren vollständig CO2-neutral bedient werden.[12]
Die Anwendungen im Bauwesen sind zwischenzeitlich sehr vielfältig, beispielsweise in Raumumfassungen. Sie wirken thermisch passiv oder mit wasserdurchflossenen Kunststoff-Kapillarrohrmatten bestückt als thermisch aktive Speicherplatten. Die zeitlichen Leistungsverläufe dieser Speicherplatten können als Einzelelemente betrachtet (z. B. Fußbodenheizungen, Wandheizungen, Kühldecken) sehr detailliert mit numerisch arbeitenden Simulationsmodellen bestimmt werden.[13] Sollen die Speicherplatten zusammen mit dem wärmetechnisch angekoppelten Raum untersucht werden, dann ist eine komplexe Nachbildung mit dem Simulationsmodell[14] zweckmäßig.
Ein neuartiges Fassadenelement („Solarwand“) speichert in vier Zentimetern Dicke so viel Wärme wie eine 30 cm dicke Ziegelwand. Tagsüber wird Wärme eingespeichert und das Element hält die Temperatur konstant auf der Schmelztemperatur des PCM, 27 °C. Eine Isolierverglasung hält den größten Teil der Wärme „unter Glas“. Im Sommer verhindert eine Prismenscheibe, dass Sonnenlicht aus einem Winkel über 40° absorbiert wird.[15]
Patente
- Patent US2114396: Heating pad. Veröffentlicht am 19. April 1938, Erfinder: Roland Lyman McFarlan, Neck Marblehead, John Bowles.
- Patent US2118586A: Thermophoric composition. Veröffentlicht am 24. Mai 1938, Erfinder: John Bowles, Roland Lyman McFarlan (C09K5/06).
- Patent DE2917192A1: Mehrfach verwendbares Wärmekissen. Veröffentlicht am 6. November 1980, Erfinder: Gustaf Arrhenius (A61 F7/03, C09K5/06).
Literatur
- Kapitel 10.5: Latente thermische Energiespeicher. In: M. Sterner, I. Stadler (Hrsg.): Energiespeicher – Bedarf, Technologie, Integration, Springer-Vieweg, 2. Auflage 2017, ISBN 978-3-662-48892-8, S. 598–610; in erster Auflage des Buches S. 553–565
- Kapitel 9.2.2 Latentwärmespeicher. In: M. Schmidt: Auf dem Weg zum Nullemissionsgebäude, Springer-Vieweg, Wiesbaden 2013, ISBN 978-3-8348-1746-4, S. 321
- Kapitel 4.4.2. Latente Wärmespeicher. In: Wärmespeicher, 5. überarbeitete Auflage, ISBN 978-3-8167-8366-4, S. 47–48
- Kapitel 3.2.2. Latent Heat Storage. In: Solar Energy Storage, Elsevier Academic Press, 2015, ISBN 978-0-12-409540-3, S. 32–35
- Latentwärmespeicher. In: H. Weik: Expert Praxislexikon: Sonnenenergie und solare Techniken, 2. überarbeitete Auflage von 2006, expert Verlag, ISBN 978-3-8169-2538-5, S. 176–177
- Johannes Goeke: Thermische Energiespeicher in der Gebäudetechnik. 1. Aufl. Springer Vieweg, 2021, ISBN 978-3-658-34509-9.
- Harald Mehling, Luisa Cabeza: Heat and cold storage with PCM, An up to date introduction into basics and applications. Springer, Berlin 2008, ISBN 978-3-540-68556-2.
Weblinks
- Latentwärmespeicher in Gebäuden (BINE Informationsdienst)
- Phasenübergang speichert Wärme (BINE Informationsdienst)
- Gütegemeinschaft Phase Change Material (PCM) e. V.
- Wärme aus der Wand (Die Zeit, 3. Dezember 2009)
- Zukunftsmärkte/Anwendungen für innovative Wärme- und Kälte-Speicher mit Phasen-Wechselmaterialien (PCM) zur Verbesserung der Energieeffizienz in ausgewählten Branchen. (Memento vom 31. Januar 2012 im Internet Archive) (2007)
Einzelnachweise
- S. Kunkel: Untersuchung der Mechanismen zur Wärmeübertragung in Direktkontaktlatentwärmespeichern. In: TU-Berlin (Hrsg.): Dissertation. Berlin 7. August 2019, S. 32.
- Seminarvortrag Daniel Oriwol: Natriumacetat als Latentwärmespeicher (Memento vom 1. Oktober 2011 im Internet Archive; PDF), 2008.
- M.Rogerson, S. Cardoso: Solidification in heat packs. In: AlChE Journal. Bd. 49, 2003, S. 505.
- Rüdiger Blume zum Wärmekissen
- Thermische Energiespeicher (Memento vom 18. Juli 2015 im Internet Archive; PDF)
- Pramod B. Salunkhe,A. H. Dhumal: MEASUREMENT OF VARIATION IN SPECIFIC HEAT OF SODIUM ACETATE TRI-HYDRATE. In: ResearchGate. Abgerufen am 16. Mai 2023.
- Michael Sterner, Ingo Stadler: Energiespeicher - Bedarf, Technologien, Integration. Abgerufen am 16. Mai 2023.
- Rüter, Horst, Reinhard, Kirsch, Flüssigsalz-Latentwärmespeicher in Salzstrukturen zur bedarfsgerechten Strombereitstellung aus Erneuerbaren Energien, GTE 106, 16–22, 2023
- Rüter, Horst, Reinhard, Kirsch,: Flüssigsalz-Latentwärmespeicher in Salzstrukturen zur bedarfsgerechten Strombereitstellung aus Erneuerbaren Energien. In: GTE. Nr. 106, 2023, S. 16–22.
- Erhöhte Reichweite von Elektrofahrzeugen im Winter. In: Website des Deutschen Zentrums für Luft- und Raumfahrt. Abgerufen am 17. Mai 2018.
- Die mobile Wärme kommt gut an im Container - Artikel in der Augsburger Allgemeinen
- LENA-Wärme für den ADAC in Penzing. Abgerufen am 7. Februar 2023.
- B. Glück: Simulationsmodell für passive und aktive Speicherplatten in Raumumfassungen und Testbeispiele
- B. Glück: Dynamisches (wärmetechnisches) Raummodell
- TU Darmstadt (Memento vom 7. Februar 2008 im Internet Archive)