Viraler Vektor
Als virale Vektoren werden Viruspartikel bezeichnet, die in der Gentechnik dafür verwendet werden, genetisches Material in Zielzellen zu schleusen. Dies können Zellen eines lebenden Organismus oder Zellen einer Zellkultur sein.
Der Transport von DNA in eine Zelle mit Hilfe eines Virus wird als Transduktion bezeichnet, die Zellen, die solche DNA tragen, als transduzierte Zellen. Virale Vektoren (gelegentlich auch als Vektorviren bezeichnet) werden in der Grundlagenforschung und in der Gentherapie verwendet. Auch Impfstoffe auf Basis viraler Vektoren sind bereits im Einsatz. Die Technik der viralen Vektoren wurde erstmals in den 1970er Jahren verwendet und seitdem ständig weiterentwickelt. Virale Vektoren enthalten im Gegensatz zu Virus-like particles (VLP) oder Liposomen mit viralen Membranproteinen (Virosomen) eine zu überbringende Nukleinsäure. Diese Nukleinsäure wird dann entweder vorübergehend abgelesen, bis sie abgebaut wird, oder sie liegt als Episom im Zellkern neben dem Genom vor, oder sie wird dauerhaft in das Genom integriert.
Natürlich vorkommende virale Vektoren sind z. B. die Polydnaviridae.
Eigenschaften
Um mit einem viralen Vektor genetisches Material in Zielzellen mittels Transduktion einzubringen, muss zunächst die gewünschte DNA-Sequenz in das Genom der Viren kloniert werden. Dabei werden in den meisten Fällen bestimmte DNA-Bereiche des viralen Genoms ersetzt, so dass die Viren nicht mehr replikationskompetent sind, da ihnen z. B. regulatorische Sequenzen oder die Gene für Enzyme, Kapsid- oder Membranproteine fehlen. Derartige Vektoren können sich nicht mehr selbst vermehren. Infektiöse Partikel können nur dann hergestellt werden, wenn durch eine Komplementation in der Zelllinie, die die Vektoren produziert, entsprechende Informationen z. B. für die fehlenden Proteine und Nukleinsäuren getrennt zur Verfügung gestellt werden. Replikationsdefiziente Vektoren haben den Vorteil, dass sie sich in der Zielzelle, die diese Informationen nicht enthält, nicht vermehren können und werden daher gegenüber unkontrolliert replikationskompetenten Vektoren bevorzugt eingesetzt. Durch homologe Rekombination in der Verpackungszelllinie können allerdings zu einem gewissen Grad wieder replikationskompetente Viren entstehen. Um dies zu vermeiden, wird das genetische Material im Zuge des Vektordesigns häufig derart verändert, dass sie in möglichst vielen Hinsichten replikationsinkompetent sind, z. B. durch mehrfache Deletionen. Werden die genetischen Informationen auf zwei verschiedene Plasmide verteilt, wird von einem Zwei-Plasmid-System gesprochen. Um die Sicherheit der Vektoren weiter zu erhöhen, werden die genetischen Informationen auch auf drei oder mehr verschiedene Plasmide verteilt, die dann zur Vektorherstellung jeweils gemeinsam transfiziert werden müssen.[1] Neben dem Vektordesign kann auch ein Proteindesign erfolgen. Dies erlaubt die gezielte Anpassung verschiedener Eigenschaften des Transgens und seines exprimierten Proteins.
Anforderungen an einen viralen Vektor sind:
- Sicherheit und geringe Genotoxizität
- Geringe Zytotoxizität und Symptomatik
- Stabilität
- Zelltypspezifität
- Größe der genetischen Verpackungskapazität
Während virale Vektoren zur Gentherapie von Gendefekten eine persistente Genexpression erzeugen sollen, werden zur Immunisierung gegen Infektionskrankheiten, zur Phagentherapie von teilweise antibiotikaresistenten Bakterien, zur Behandlung von Tumoren mit onkolytischen Viren oder zur Erzeugung induzierter pluripotenter Stammzellen[2] transiente virale Vektoren eingesetzt. Um einen vorzeitigen Abbau eines viralen Vektors nach Verabreichung zu vermeiden, werden gelegentlich virale Vektoren und ihre Subtypen so ausgewählt, dass möglichst keine präexistierenden und an die Proteine des Virusvektors bindenden Antikörper bestehen.[3][4][5]
Anwendungen
Grundlagenforschung
Virale Vektoren wurden ursprünglich als Alternative zu der Transfektion von nackter DNA für molekulargenetische Experimente entwickelt. Verglichen mit traditionellen Methoden wie der Calcium-Phosphat-Transfektion kann durch die Transduktion sichergestellt werden, dass nahezu 100 % der Zellen das genetische Material erhalten, ohne dass die Lebensfähigkeit der Zellen nennenswert eingeschränkt wird. Außerdem sind manche Viren und auch die von ihnen abgeleiteten Viralen Vektoren in der Lage, ihre DNA in das Genom der Zielzelle zu integrieren, so dass die Expression der DNA stabil verankert werden kann und sogar an die Tochterzellen weitervererbt werden kann. Da die Produktion von viralen Vektoren sehr aufwändig ist, sind für viele Anwendungen die sich stetig verbessernden Transfektionstechniken jedoch weiterhin die bessere Lösung.
Gene, die Proteine codieren, können mit Hilfe von viralen Vektoren exprimiert werden, um die Funktion des jeweiligen Proteins zu untersuchen. Vektoren, besonders retrovirale Vektoren, die stabile Markergene wie GFP exprimieren, werden für die permanente Markierung von Zellen eingesetzt, um sie und ihre Nachkommen verfolgen zu können. Dies geschieht beispielsweise bei Xenotransplantationen.
In den Vektor klonierte Gene, die für shRNAs und miRNAs kodieren, können für RNA-Interferenz-Experimente eingesetzt werden.
Gentherapie
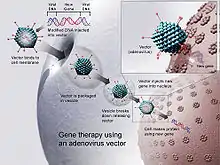
Verschiedene gentherapeutische Studien sind bereits seit Beginn der 1990er Jahre durchgeführt worden, bei denen unterschiedliche virale Vektoren zum Einsatz kamen. Mit Hilfe dieser Vektoren soll das defekte Gen, bei einer monogenetischen Erbkrankheit beispielsweise das disfunktionelle ererbte Gen, durch ein gesundes ersetzt werden. Dabei ergeben sich verschiedene Schwierigkeiten je nachdem, welcher Vektor und welche Methode verwendet wird. In vitro wurden bereits große Fortschritte erzielt, bei der Anwendung im Patienten waren diese jedoch immer von Risiken begleitet, weshalb die Gentherapie noch keine breite Anwendung gefunden hat. Die Immunreaktionen des Patienten gegen den Vektor kann Komplikationen hervorrufen, so im Fall von Jesse Gelsinger, der 1999 mit einem adenoviralen Vektor behandelt wurde. Aus diesen Gründen wird es notwendig sein, für jede Krankheit, die gentherapeutisch behandelt werden soll, einen geeigneten und spezifischen viralen Vektor zu entwickeln.[6]
Retrovirale Vektoren beispielsweise integrieren ihre Genome in das Genom der Wirtszelle. Dabei geschieht die einzelne Integration an einer zufälligen Stelle im Genom, insgesamt werden jedoch je nach Virustyp bestimmte Stellen wie aktive Gene bei HIV oder Promotorregionen bei MLV stark bevorzugt. An diesen Integrationsorten kann das Virusgenom Gene der Wirtszelle unterbrechen oder natürlicherweise stillgelegte Gene aktivieren, wobei man annimmt, dass dies je nach Integrationsmuster des jeweiligen Virus mehr oder weniger häufig geschieht. Dies kann zur Entartung der Zelle und damit zur Tumorbildung führen, so geschehen in einer Gentherapie-Studie von Severe Combined Immunodeficiency (SCID), die 1999 in Frankreich durchgeführt wurde. Vier der 10 behandelten Kinder entwickelten Leukämien infolge der Behandlung.[7]
Impfstoffe
Transiente Viren, die eine codierende Sequenz von Pathogenen zur transienten Expression tragen, werden derzeit als Impfstoffe gegen Pathogene getestet. Der virale Vektor bringt die DNA oder RNA eines Teils des Pathogens in die Zelle, wo sie exprimiert wird. Ein Impfstoff auf Basis eines viralen Vektors wird als Vektor-Impfstoff bezeichnet.[8] Zugelassene Vektor-Impfstoffe sind cAd3-ZEBOV, VSV-EBOV, AZD1222, Ad26.COV2.S und Sputnik V – alle auf adenoviraler oder VSV-Basis. Bei den zur Impfung verwendeten viralen Vektoren tritt einige Tage nach der ersten Anwendung oftmals eine Vektorimmunität auf, bei der Antikörper gegen Proteine des Vektorvirus gebildet werden, die bei einer späteren erneuten Anwendung zu einem vorzeitigen Abbau des viralen Vektors führen, bevor eine Wirkung entfaltet werden kann.[9][10][11] Daher werden bei erforderlicher mehrfacher Anwendung oftmals Prime-Boost-Ansätze verfolgt, bei der unterschiedliche virale Vektoren, aber die gleichen Transgene verwendet werden.
Geschichte
Paul Berg benutzte 1976 ein modifiziertes SV40-Virus, das DNA des Bakteriophagen Lambda enthielt, um in Zellkultur gehaltene Affennierenzellen zu infizieren.[12] Die erste Verwendung eines viralen Vektors zur Impfung – ein MVA-Virus, das für HBsAg codierte – wurde 1983 von der Arbeitsgruppe von Bernard Moss publiziert.[13][14] Seit Mitte der 1980er werden retrovirale Vektoren eingesetzt, die Markergene enthalten, um Zellen damit zu markieren und ihre Entwicklung innerhalb eines Organismus verfolgen zu können.[15] Dadurch wurde die Möglichkeit vorstellbar, Gene als Therapeutikum in Zielzellen einzusetzen.
Typen viraler Vektoren (Vektorviren)
Fortlaufend werden neue virale Vektoren entwickelt und untersucht, darunter das Masernvirus (MV), Lymphozytäre-Choriomeningitis-Virus (LCMV), Zytomegalievirus (CMV) und Herpes-simplex-Virus (HSV).[16]
Retroviren
Retroviren stehen derzeit im Zentrum der gentherapeutischen Forschung und sind aufgrund ihrer Eigenschaften die am weitesten verbreiteten persistenten Vektoren.[17][18] Rekombinante Retroviren können stabil in das Wirtsgenom integrieren und sind das derzeit einzige Instrument, um monogenetische Erbkrankheiten dauerhaft zu heilen. Bis zum Jahr 2007 wurden knapp 300 klinische Studien mit retroviralen Vektoren durchgeführt.
Einfache Retroviren, wie z. B. das zur Gattung der Gammaretroviren gehörende Murine Leukämievirus, sind auf die Auflösung des Zellkerns während der Mitose angewiesen, um in das Wirtsgenom zu integrieren und eignen sich daher nicht zur Transduktion ruhender Zellen, wie beispielsweise Nervenzellen[19]. Weil gammaretrovirale Vektoren das Risiko bergen, durch die starken U3-Enhancer-Elemente in ihren LTRs potenzielle Onkongene in der Nähe ihres Integrationsortes zu aktivieren,[20][21] wurden sogenannte SIN-Vektoren (von self inactivating) entwickelt, denen diese Enhancer im 3'-LTR-Bereich fehlen. Nach der Reversen Transkription und der Integration des Provirus ins Wirtsgenom fehlen diese auch im 5'-LTR-Bereich. Es konnte gezeigt werden, dass sich das Risiko einer Protoonkogenaktivierung dadurch verringert, völlig verhindert werden kann es jedoch auch bei SIN-Vektoren nicht.[22][23] Der Tropismus eines viralen Vektors kann durch Pseudotypisierung verändert werden, z. B. mit dem Glykoprotein des vesicular stomatitis virus (VSV-G).[24]
Lentiviren

Lentiviren sind eine Gattung innerhalb der Retroviren. Sie können im Gegensatz zu Gammaretroviren auch in ruhenden Zellen replizieren und haben daher ein potenziell breiteres Anwendungsspektrum. Die komplexere Biologie der Lentiviren ist der Grund, warum die Entwicklung von Vektoren aus Lentiviren schwieriger ist und weshalb diese Vektoren erst nach längerer Vorlaufzeit brauchbare Ergebnisse wie beispielsweise hohe Titer lieferten.[25] Nach einer im November 2006 publizierten ersten klinischen Studie, bei der lentivirale Vektoren zum Einsatz kamen, um die Replikation von HIV-1 in Patienten mit Aids zu unterdrücken, wurde positive Bilanz gezogen.[26] Auch von lentiviralen Vektoren wurden SIN-Vektoren erzeugt,[27] die einen wichtigen Fortschritt für die Sicherheit bedeuten.[28]
Foamyviren
Foamyviren sind eine zoonotische Unterfamilie innerhalb der Retroviren. Einen Vorteil gegenüber einfachen Retroviren stellt beispielsweise das große Genom der Foamyviren dar, so dass auch größere therapeutische Gene verpackt werden können. Gegenüber Lentiviren ist vor allem die allgemeine Apathogenität der Foamyviren hervorzuheben,[29] so dass selbst bei replikationskompetenten Vektoren von einer geringen Gefahr auszugehen ist. Auch besitzen Foamyviren weitere wünschenswerte Eigenschaften, wie z. B. dass im Gegensatz zu Orthoretroviren aufgrund des genomabhängigen Zusammenbaus des Virions und der Env-abhängigen Freisetzung keine bei der Gentherapie unbrauchbaren Virus-like particles gebildet werden[30] und bei der Integration weniger als bei MLV oder HIV aktive Gene bzw. Transkriptionsstartstellen bevorzugt werden.[31][32][33] Ein Problem stellt allerdings beispielsweise die mangelnde Pseudotypisierbarkeit der Foamyviren dar.[34] Auch bei Foamyviren werden SIN-Vektoren verwendet.[35][36]
Adenoviren
Anders als die Lentiviren integrieren Adenoviren nicht in das Genom der Zelle. Die Virus-DNA gelangt zwar in den Zellkern,[37] wird jedoch nicht während der Zellteilung repliziert. Die DNA von Adenoviren liegt episomal vor, also getrennt von der DNA der Wirtszelle. Adenovirusvektoren sind daher nichtintegrierend und nichtreplizierend.[38] Ihr Einsatz für die Grundlagenforschung ist hierdurch limitiert. Dafür können gerade menschliche Zellen u. a. wegen der Adenovirusrezeptoren sehr leicht durch Adenoviren infiziert werden.[38] Zudem erzeugen Adenoviren im Menschen wenig Symptome, lösen aber gleichzeitig eine starke Immunreaktion aus.[39] Ihr Hauptanwendungsbereich liegt infolgedessen in der Immunisierung[40] oder in der Gentherapie, wenn nur eine vorübergehende Expression des Zielgens gewünscht ist. Dies ist unter anderem bei Impfstoffen wie cAd3-ZEBOV und in der Tumorbekämpfung mit onkolytischen Viren der Fall.[41] In der dritten Generation adenoviraler Vektoren ist die Produktion der Virionen von Kofaktoren in einer Verpackungszelllinie abhängig.[42][43] Auch AdV-Vektoren induzieren eine Vektorimmunität, das bedeutet, das Immunsystem richtet sich auch gegen den Vektor selbst, sodass man einen Serotyp pro Patienten nur einmal einsetzen kann.[44][45] Die präexisitierende Seroprävalenz gegen Adenoviren wurde weltweit kartiert.[46]
Eine Anwendung von Adenoviren erfolgt bei der Bekämpfung von COVID-19 mit einigen COVID-19-Impfstoffen.[47] Bei Sputnik V (Gam-COVID-Vac) exprimieren zwei modifizierte rekombinante humane Viren (Adenovirus Typ 26 (rAd26-S) und Adenovirus Typ 5 (rAd5-S)) das Spikeprotein von SARS-CoV-2. Um die Vektorimmunität zu umgehen, kommen beim Sputnik-V-Impfstoff zwei verschiedene Adenovirustypen zum Einsatz, die in einem zeitlichen Abstand appliziert werden (Prime/Boost). Andere Beispiele für auf Adenoviren basierende Vektorimpfung sind die Impfstoffe AZD1222 und Ad26.COV2.S.
Erstmals wurden Adenoviren als Vektoren Anfang der 1990er Jahre beim Menschen erprobt.[48]
Adeno-assoziierte Viren
Das Adeno-assoziierte Virus (AAV) führt beim Menschen zu asymptomatischen Koinfektionen während einer adenoviralen Infektion und wird zur Erzeugung persistenter viraler Vektoren verwendet.[49] Die Adeno-assoziierten viralen Vektoren haben eine maximale DNA-Länge von acht Kilobasen (einzelsträngig), die noch in Virionen verpackt werden können.[50] Bei der Verwendung selbst-komplementärer DNA sinkt die maximale Länge eines Transgens auf fünf Kilobasen, bei Längen darüber sinkt der Virustiter.[51] Da wie bei allen viralen Vektoren Antikörper gegen die viralen Proteine (in diesem Fall gegen Kapsidproteine) im Rahmen einer angeborenen und einer adaptiven Vektorimmunität entstehen, sodass man zur Vermeidung eines vorzeitigen Abbaus des Vektors oder überschießender Immunreaktionen einen Serotyp pro Patienten nur einmal einsetzen kann,[52] werden fortlaufend neue Serotypen entwickelt.[53][54][55] Jedoch wurden Integrationen von AAV-Vektoren auch in transkriptionsaktiven Bereichen des Genoms gefunden, was zur Entstehung von Tumoren beitragen kann.[56][57] Eladocagen exuparvovec ist ein für die Anwendung am Menschen zugelassener AAV2-Vektor.
Vesicular Stomatitis Virus
Das Vesicular stomatitis virus ist ein Virus, das in Menschen nur wenig Symptome erzeugt und zur Erzeugung von transienten, aber replikationskompetenten Vektoren zu Impfzwecken verwendet wird,[58] z. B. VSV-EBOV.
Newcastle Disease Virus
Das Newcastle-Disease-Virus wird als transienter Vektor für Impfzwecke und als onkolytisches Virus verwendet.[59]
Modified Vaccinia Ankara
Das Modified Vaccinia Ankara (MVA) ist ein attenuiertes Pockenvirus, das seit den 1970er Jahren als Pockenimpfstoff zugelassen ist und vor allem in Bayern eingesetzt wurde. Nach Hinzufügen weiterer Antigene wird es als transienter Vektor zu Impfzwecken gegen weitere Krankheiten verwendet.[60] Aufgrund der Vektorimmunität ist das MVA nur bei Impflingen wirksam, die zuvor keine Pockenimpfung erhalten hatten.
Alphavirus-Replikon
Das Replikon des Alphavirus ist ein transienter Vektor, das im Zytosol repliziert wird (replikationskompetent). Als Alphaviren werden nicht-humanpathogene Stämme verwendet. Die RNA des Alphavirus-Replikons kann auch ohne Virushülle oder Kapsid transfiziert werden. Alphavirus-Replikons erzeugen einen zytopathischen Effekt.[61] Durch die Replikation wird der Wirkungszeitraum verlängert, durch den cytopathischen Effekt jedoch langsam beendet.
Baculoviren
Baculovirale Vektoren werden in Insektenzellkulturen unter anderem zur Produktion von AAV-Vektoren eingesetzt.[51][62] Die Anwendung in der Zellkultur (ohne adaptives Immunsystem) ermöglicht auch bei transienten Viren eine kontinuierliche Kultur. Die Verwendung von Insektenzellen reduziert das Risiko einer Kontamination mit Pathogenen des Menschen, da humanpathogene Viren in der Regel keine Insektenzellen infizieren können. Insektenzellen wachsen zudem bereits bei Raumtemperatur und ohne CO2-Begasung, weisen jedoch teilweise unterschiedliche Glykosylierungsmuster ihrer Proteine auf. Es gibt auch Baculovirusvektoren für Säugerzellen.[63]
Literatur
- Gary L. Buchschacher, Jr.: Lentiviral Vector Systems for Gene Transfer Kluwer Academic/ Plenum Publishers, New York 2003, ISBN 0-306-47702-5.
- Curtis A. Machida (Hrsg.): Viral Vectors for Gene Therapy. Methods and Protocols Humana Press, 2002, ISBN 1-58829-019-0.
Weblinks
- Virus Vectors & Gene Therapy: Problems, Promises & Prospects. (Memento vom 26. Oktober 2014 im Webarchiv archive.today)
- Theo Dingermann: SARS-CoV-2-Impfstoffe – Vektorviren als Plattform. In: Pharmazeutische Zeitung. Hrsg. Avoxa - Mediengruppe Deutscher Apotheker GmbH, 9. Juli 2020, abgerufen am 23. November 2020.
- A Potential Cure for AIDS: Defeating HIV With a Single Injection. Auf: SciTechDaily vom 5. Juli 2022. Quelle: Tel-Aviv University.
Einzelnachweise
- E. Hoffmann, G. Neumann, Y. Kawaoka, G. Hobom, R. G. Webster: A DNA transfection system for generation of influenza A virus from eight plasmids. In: Proc Natl Acad Sci USA. Band 97(11), 2000, S. 6108–6113. PMID 10801978; PMC 18566 (freier Volltext).
- M. Stadtfeld u. a.: Induced Pluripotent Stem Cells Generated Without Viral Integration. science-online, 25. September 2008, doi:10.1126/science.1162494
- Stefan Kostense, Wouter Koudstaal, Mieke Sprangers, Gerrit Jan Weverling, Germaine Penders, Niels Helmus, Ronald Vogels, Margreet Bakker, Ben Berkhout, Menzo Havenga, Jaap Goudsmit: Adenovirus types 5 and 35 seroprevalence in AIDS risk groups supports type 35 as a vaccine vector. In: AIDS. 18, 2004, S. 1213, doi:10.1097/00002030-200405210-00019.
- Shawn M. Sumida, Diana M. Truitt, Angelique A. C. Lemckert, Ronald Vogels, Jerome H. H. V. Custers, Marylyn M. Addo, Shahin Lockman, Trevor Peter, Fred W. Peyerl, Michael G. Kishko, Shawn S. Jackson, Darci A. Gorgone, Michelle A. Lifton, Myron Essex, Bruce D. Walker, Jaap Goudsmit, Menzo J. E. Havenga, Dan H. Barouch: Neutralizing Antibodies to Adenovirus Serotype 5 Vaccine Vectors Are Directed Primarily against the Adenovirus Hexon Protein. In: The Journal of Immunology. 174, 2005, S. 7179, doi:10.4049/jimmunol.174.11.7179.
- R. Vogels, D. Zuijdgeest, R. van Rijnsoever, E. Hartkoorn, I. Damen, M. P. de Béthune, S. Kostense, G. Penders, N. Helmus, W. Koudstaal, M. Cecchini, A. Wetterwald, M. Sprangers, A. Lemckert, O. Ophorst, B. Koel, M. van Meerendonk, P. Quax, L. Panitti, J. Grimbergen, A. Bout, J. Goudsmit, M. Havenga: Replication-deficient human adenovirus type 35 vectors for gene transfer and vaccination: efficient human cell infection and bypass of preexisting adenovirus immunity. In: Journal of Virology. Band 77, Nummer 15, August 2003, S. 8263–8271, doi:10.1128/jvi.77.15.8263-8271.2003, PMID 12857895, PMC 165227 (freier Volltext).
- J. C. Pagès, T. Bru: Toolbox for retrovectorologists. In: J Gene Med. Band 6 Suppl 1, 2004, S. S67–S82. PMID 14978752.
- Reports of a second serious adverse event in a clinical trial of gene therapy for X-linked severe combined immune deficiency (X-SCID) (Memento vom 28. Oktober 2008 im Internet Archive), Pressemitteilung der European Society of Gene Therapy (ESGT) zum vierten Leukämiefall, 18. Januar 2003.
- Aufklärungsmerkblatt zur Schutzimpfung gegen COVID-19 (mit Vektor-Impfstoff). In: Rote-Hand-Brief – Rote-Hand-Brief: Vaxzevria / COVID-19 Vaccine AstraZeneca. PEI, 9. August 2021, abgerufen am 25. September 2021.
- N. Chirmule, W. Xiao, A. Truneh, M. A. Schnell, J. V. Hughes, P. Zoltick, J. M. Wilson: Humoral immunity to adeno-associated virus type 2 vectors following administration to murine and nonhuman primate muscle. In: Journal of Virology. Band 74, Nummer 5, März 2000, S. 2420–2425, doi:10.1128/jvi.74.5.2420-2425.2000, PMID 10666273, PMC 111724 (freier Volltext).
- C. S. Peden, C. Burger, N. Muzyczka, R. J. Mandel: Circulating anti-wild-type adeno-associated virus type 2 (AAV2) antibodies inhibit recombinant AAV2 (rAAV2)-mediated, but not rAAV5-mediated, gene transfer in the brain. In: Journal of Virology. Band 78, Nummer 12, Juni 2004, S. 6344–6359, doi:10.1128/JVI.78.12.6344-6359.2004, PMID 15163728, PMC 416536 (freier Volltext).
- C. D. Scallan, H. Jiang, T. Liu, S. Patarroyo-White, J. M. Sommer, S. Zhou, L. B. Couto, G. F. Pierce: Human immunoglobulin inhibits liver transduction by AAV vectors at low AAV2 neutralizing titers in SCID mice. In: Blood. Band 107, Nummer 5, März 2006, S. 1810–1817, doi:10.1182/blood-2005-08-3229, PMID 16249376.
- S. P. Goff, P. Berg: Construction of hybrid viruses containing SV40 and lambda phage DNA segments and their propagation in cultured monkey cells. In: Cell. 9, 1976, S. 695–705. PMID 189942
- G. L. Smith, M. Mackett, B. Moss: Infectious vaccinia virus recombinants that express hepatitis B virus surface antigen. In: Nature. Band 302, Nummer 5908, April 1983, S. 490–495, doi:10.1038/302490a0, PMID 6835382.
- C. Y. Yong, H. K. Ong, S. K. Yeap, K. L. Ho, W. S. Tan: Recent Advances in the Vaccine Development Against Middle East Respiratory Syndrome-Coronavirus. In: Frontiers in Microbiology. Band 10, 2019, S. 1781, doi:10.3389/fmicb.2019.01781, PMID 31428074, PMC 6688523 (freier Volltext).
- R. Mann, R. C. Mulligan, D. Baltimore: Construction of a retrovirus packaging mutant and its use to produce helper-free defective retrovirus. In: Cell. 33(1), May 1983, S. 153–159. PMID 6678608
- E. Sasso, A. M. D’Alise, N. Zambrano, E. Scarselli, A. Folgori, A. Nicosia: New viral vectors for infectious diseases and cancer. In: Seminars in immunology. Band 50, 08 2020, S. 101430, doi:10.1016/j.smim.2020.101430, PMID 33262065.
- F. D. Bushman: Retroviral integration and human gene therapy. In: J Clin Invest. 117(8), Aug 2007, S. 2083–2086. PMID 17671645
- J. D. Suerth, V. Labenski, A. Schambach: Alpharetroviral Vectors: From a Cancer-Causing Agent to a Useful Tool for Human Gene Therapy. In: Viruses. Band 6, Nummer 12, 2014, S. 4811–4838, ISSN 1999-4915. doi:10.3390/v6124811. PMID 25490763.
- ViralZone: Gammaretrovirus. Abgerufen am 13. Februar 2017 (amerikanisches Englisch).
- L. Biasco, C. Baricordi, A. Aiuti: Retroviral integrations in gene therapy trials. In: Mol Ther. Band 20(4), 2012, S. 709–716. doi:10.1038/mt.2011.289. PMID 22252453; PMC 3321603 (freier Volltext).
- K. I. Lim: Retroviral integration profiles: their determinants and implications for gene therapy. In: BMB Rep. Band 45(4), 2012, S. 207–212. PMID 22531129.
- U. Modlich, J. Bohne, M. Schmidt, C. von Kalle, S. Knöss, A. Schambach, C. Baum: Cell-culture assays reveal the importance of retroviral vector design for insertional genotoxicity. In: Blood. 108(8), 15. Okt 2006, S. 2545–2553. Epub 2006 Jul 6. PMID 16825499
- D. Zychlinski, A. Schambach, U. Modlich, T. Maetzig, J. Meyer, E. Grassman, A. Mishra, C. Baum: Physiological Promoters Reduce the Genotoxic Risk of Integrating Gene Vectors. In: Mol Ther. 19. Feb 2008. PMID 18388936
- J. Cronin, X. Y. Zhang, J. Reiser: Altering the tropism of lentiviral vectors through pseudotyping. In: Current gene therapy. Band 5, Nummer 4, August 2005, S. 387–398, ISSN 1566-5232. PMID 16101513. PMC 1368960 (freier Volltext).
- T. Kafri: Gene delivery by lentivirus vectors. An overview. In: Methods Mol Biol. Band 246, 2004, S. 367–390. PMID 14970605.
- D. B. Kohn: Lentiviral vectors ready for prime-time. In: Nat Biotechnol. Band 25(1), 2007, S. 65–66. PMID 17211402.
- T. Iwakuma, Y. Cui, L. J. Chang: Self-Inactivating Lentiviral Vectors with U3 and U5 Modifications. In: Virology. Band 261(1), 1999, S. 120–132. PMID 10441560.
- Q. Yang, A. Lucas, S. Son, L. J. Chang: Overlapping enhancer/promoter and transcriptional termination signals in the lentiviral long terminal repeat. In: Retrovirology. 4, 2007, S. 4, doi:10.1186/1742-4690-4-4.
- M. Linial: Why aren't foamy viruses pathogenic? In: Trends Microbiol. Band 8, 2000, S. 284–289.
- D. Lindemann, A. Rethwilm: Foamy virus biology and its application for vector development. In: Viruses. Band 3(5), 2011, S. 561–585. PMID 21994746; PMC 3185757 (freier Volltext).
- G. D. Trobridge, D. G. Miller, M. A. Jacobs, J. M. Allen, H. P. Kiem, R. Kaul, D. W. Russell: Foamy virus vector integration sites in normal human cells. In: Proc. Natl. Acad. Sci. U. S. A. Band 103, 2006, S. 1498–1503.
- A. Nowrouzi, M. Dittrich, C. Klanke, M. Heinkelein, M. Rammling, T. Dandekar, C. von Kalle, A. Rethwilm: Genome-wide mapping of foamy virus vector integrations into a human cell line. In: J Gen Virol. Band 87, 2006, S. 1339–1347.
- T. R. Bauer, J. M. Allen, M. Hai, L. M. Tuschong, I. F. Khan, E. M. Olson, R. L. Adler, T. H. Burkholder, Y. C. Gu, D. Russell u. a.: Successful treatment of canine leukocyte adhesion deficiency by foamy virus vectors. In: Nat. Med. Band 14, 2008, S. 93–97.
- T. Pietschmann, M. Heinkelein, M. Heldmann, H. Zentgraf, A. Rethwilm, D. Lindemann: Foamy virus capsids require the cognate envelope protein for particle export. In: J. Virol. Band 73, 1999, S. 2613–2621.
- T. Wiktorowicz, K. Peters, N. Armbruster, A. F. Steinert, A. Rethwilm: Generation of an improved foamy virus vector by dissection of cis-acting sequences. In: J. Gen. Virol. Band 90, 2009, S. 481–487.
- G. Trobridge, N. Josephson, G. Vassilopoulos, J. Mac, D. W. Russell: Improved foamy virus vectors with minimal viral sequences. In: Mol. Ther. Band 6, 2002, S. 321–328.
- Frederik Jötten: Wird Adenovirus-DNA ins Genom eingebaut? In Spektrum.de vom 17. Februar 2021, abgerufen am 7. Juni 2021.
- Cody S. Lee et al.: Adenovirus-mediated gene delivery: Potential applications for gene and cell-based therapies in the new era of personalized medicine. In: Genes & Diseases. Band 4, Nr. 2, 1. Juni 2017, S. 43–63, doi:10.1016/j.gendis.2017.04.001.
- C. F. Daussy, N. Pied, H. Wodrich: Understanding Post Entry Sorting of Adenovirus Capsids; A Chance to Change Vaccine Vector Properties. In: Viruses. Band 13, Nummer 7, 06 2021, S. , doi:10.3390/v13071221, PMID 34202573, PMC 8310329 (freier Volltext).
- J. D. Bassett, S. L. Swift, J. L. Bramson: Optimizing vaccine-induced CD8(+) T-cell immunity: focus on recombinant adenovirus vectors. In: Expert Rev Vaccines. 10(9), 2011, S. 1307–1319. PMID 21919620.
- A. U. Ahmed, I. V. Ulasov, R. W. Mercer, M. S. Lesniak: Maintaining and loading neural stem cells for delivery of oncolytic adenovirus to brain tumors. In: Methods Mol Biol. Band 797, 2012, S. 97–109. PMID 21948472.
- E. Dormond, A. A. Kamen: Manufacturing of adenovirus vectors: production and purification of helper dependent adenovirus. In: Methods Mol Biol. Band 737, 2011, S. 139–156. PMID 21590396.
- A. C. Silva, C. Peixoto, T. Lucas, C. Küppers, P. E. Cruz, P. M. Alves, S. Kochanek: Adenovirus vector production and purification. In: Curr Gene Ther. Band 10(6), 2010, S. 437–455. PMID 21054247.
- B. Thaci, I. V. Ulasov, D. A. Wainwright, M. S. Lesniak: The challenge for gene therapy: innate immune response to adenoviruses. In: Oncotarget. Band 2(3), 2011, S. 113–121. PMID 21399236; PMC 3092742 (freier Volltext).
- Y. S. Ahi, D. S. Bangari, S. K. Mittal: Adenoviral vector immunity: its implications and circumvention strategies. In: Curr Gene Ther. Band 11(4), 2011, S. 307–320. PMID 21453277.
- R. Calcedo, L. H. Vandenberghe, G. Gao, J. Lin, J. M. Wilson: Worldwide epidemiology of neutralizing antibodies to adeno-associated viruses. In: The Journal of Infectious Diseases. Band 199, Nummer 3, Februar 2009, S. 381–390, doi:10.1086/595830, PMID 19133809.
- N. Bar-Zeev, T. Inglesby: COVID-19 vaccines: early success and remaining challenges In: 'The Lancet' Band 396, Ausgabe 10255, 2020, S. 868–869. doi:10.1016/S0140-6736(20)31867-5
- J. Zabner et al.: Adenovirus-mediated gene transfer transiently corrects the chloride transport defect in nasal epithelia of patients with cystic fibrosis. In: Cell. Band 75, Nr. 2, 22. Oktober 1993, S. 207–216, doi:10.1016/0092-8674(93)80063-k, PMID 7691415.
- G. Murlidharan, R. J. Samulski, A. Asokan: Biology of adeno-associated viral vectors in the central nervous system. In: Frontiers in molecular neuroscience. Band 7, 2014, S. 76, ISSN 1662-5099. doi:10.3389/fnmol.2014.00076. PMID 25285067. PMC 4168676 (freier Volltext).
- D. M. McCarty: Self-complementary AAV vectors; advances and applications. In: Mol Ther. Band 16(10), 2008, S. 1648–1656. PMID 18682697.
- R. M. Kotin: Large-scale recombinant adeno-associated virus production. In: Hum Mol Genet. Band 20(R1), 2011, S. R2–R6. PMID 21531790; PMC 3095058 (freier Volltext).
- F. Mingozzi, K. A. High: Immune responses to AAV in clinical trials. In: Curr Gene Ther. Band 11(4), 2011, S. 321–330. PMID 21557723.
- I. Kwon, D. V. Schaffer: Designer gene delivery vectors: Molecular engineering and evolution of adeno-associated viral vectors for enhanced gene transfer. In: Pharmaceut Res. Band 25, 2008, S. 489–499.
- E. Ayuso, F. Mingozzi, F. Bosch: Production, purification and characterization of adeno-associated vectors. In: Curr Gene Ther. Band 10(6), 2010, S. 423–36. PMID 21054248.
- J. Wang, S. M. Faust, J. E. Rabinowitz: The next step in gene delivery: molecular engineering of adeno-associated virus serotypes. In: Journal of Molecular and Cellular Cardiology. Band 50(5), 2011, S. 793–802. PMID 21029739.
- D. R. Deyle, D. W. Russell: Adeno-associated virus vector integration. In: Curr Opin Mol Ther. Band 11(4), 2009, S. 442–447. PMID 19649989; PMC 2929125 (freier Volltext).
- A. Donsante, D. G. Miller, Y. Li, C. Vogler, E. M. Brunt, D. W. Russell, M. S. Sands: AAV vector integration sites in mouse hepatocellular carcinoma. In: Science. Band 317(5837), 2007, S. 477. PMID 17656716.
- J. S. Richardson, J. D. Dekker, M. A. Croyle, G. P. Kobinger: Recent advances in Ebolavirus vaccine development. In: Human vaccines. Band 6, Nummer 6, Juni 2010, S. 439–449, ISSN 1554-8619. PMID 20671437.
- V. Schirrmacher, P. Fournier: Multimodal cancer therapy involving oncolytic newcastle disease virus, autologous immune cells, and bi-specific antibodies. In: Frontiers in oncology. Band 4, 2014, S. 224, ISSN 2234-943X. doi:10.3389/fonc.2014.00224. PMID 25309868. PMC 4160967 (freier Volltext).
- P. F. McKay, A. V. Cope, J. F. Mann, S. Joseph, M. Esteban, R. Tatoud, D. Carter, S. G. Reed, J. Weber, R. J. Shattock: Glucopyranosyl lipid A adjuvant significantly enhances HIV specific T and B cell responses elicited by a DNA-MVA-protein vaccine regimen. In: PloS one. Band 9, Nummer 1, 2014, S. e84707, ISSN 1932-6203. doi:10.1371/journal.pone.0084707. PMID 24465426. PMC 3900398 (freier Volltext).
- T. Osada, M. A. Morse, A. Hobeika, H. K. Lyerly: Novel recombinant alphaviral and adenoviral vectors for cancer immunotherapy. In: Seminars in oncology. Band 39, Nummer 3, Juni 2012, S. 305–310, ISSN 1532-8708. doi:10.1053/j.seminoncol.2012.02.013. PMID 22595053. PMC 3607360 (freier Volltext).
- M. M. Segura, A. A. Kamen, A. Garnier: Overview of current scalable methods for purification of viral vectors. In: Methods Mol Biol. Band 737, 2011, S. 89–116. PMID 21590394.
- T. A. Kost, J. P. Condreay: Recombinant baculoviruses as mammalian cell gene-delivery vectors. In: Trends in biotechnology. Band 20, Nummer 4, April 2002, S. 173–180, PMID 11906750.