Vanadium(II)-iodid
Vanadium(II)-iodid ist eine chemische Verbindung der Elemente Vanadium und Iod.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
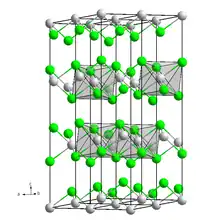 | ||||||||||||||||
| _ V2+ _ I− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Vanadium(II)-iodid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | VI2 | |||||||||||||||
| Kurzbeschreibung |
rotvioletter, kristalliner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 304,75 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
5,44 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
850 °C[2] | |||||||||||||||
| Löslichkeit |
löst sich in Wasser unter Bildung von [V(H2O)6]2+-Ionen[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Vanadium(II)-iodid kann durch Disproportionierung von Vanadium(III)-iodid bei 280 °C gewonnen werden:[5]
Ebenfalls möglich ist die Darstellung aus den Elementen bei etwa 500 °C. Erfolgt die Reaktion mit einem geringen Iod-Überschuss entsteht die schwarze Form der Verbindung.[6]
Eigenschaften
Physikalische Eigenschaften
Vanadium(II)-iodid kommt in zwei Formen vor. Die rote Form zerfließt erst nach mehreren Stunden an feuchter Luft. In Wasser löst sie sich auch beim Erwärmen nur langsam, allerdings vollständig. Dagegen ist die schwarze Form ähnlich feuchtigkeitsempfindlich wie Vanadium(III)-iodid. Die rote Form bildet sehr dünne Blättchen, die schwarze tritt in hexagonalen Säulen auf. Die trigonale Kristallstruktur der roten Form entspricht der trigonalen Form von Cadmium(II)-iodid mit der Raumgruppe P3m1 (Raumgruppen-Nr. 164) und den Gitterparametern a = 4,000 Å, c = 6,670 Å.[6]
Chemische Eigenschaften
Vanadium(II)-iodid ist ein starkes Reduktionsmittel, das sogar Stickstoff in Anwesenheit von Magnesiumhydroxid zu Hydrazin reduziert.[3]
Es löst sich in Wasser unter Bildung von [V(H2O)6]2+-Ionen:[3]
Einzelnachweise
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1545.
- Vanadium(II)-iodid auf webelements.com
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1550.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Vanadium diiodide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 28. Juli 2019.
- Lothar Kolditz: Anorganische Chemie Teil 2. VEB Deutscher Verlag der Wissenschaften, Berlin, 1980, S. 641.
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1413.