Van-Leusen-Reaktion
Die Van-Leusen-Reaktion ist eine Namensreaktion der organischen Chemie zur Synthese von Nitrilen. Dazu wird ein Keton mit Tosylmethylisocyanid (TosMIC) umgesetzt. Diese Reaktion wurde 1977 erstmals beschrieben und ist nach ihrem Entdecker, dem niederländischen Chemiker Albert van Leusen (1933–2019)[1], benannt.[2]
Übersichtsreaktion

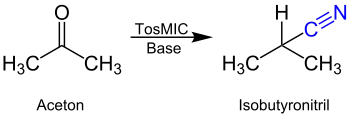
Die Reaktion findet zwischen einem Keton und Tosylmethylisocyanid statt. Die Strukturformel von Tosylmethylisocyanid, das im Folgenden mit TosMIC abgekürzt wird, kann in der nebenstehenden Abbildung eingesehen werden. Beispielhaft ist hier die Reaktion von Aceton zum Isobutyronitril dargestellt:
Unter bestimmten Bedingungen kann die Van-Leusen-Reaktion auch mit Aldehyden durchgeführt werden.[3]
Reaktionsmechanismus
Am Beispiel Aceton soll nun ein möglicher Reaktionsmechanismus für die Van-Leusen-Reaktion erläutert werden.[2][3] Zur Vereinfachung ist die Tosylgruppe des TosMIC-Moleküls, die in der obigen Strukturformel grün markiert ist, mit "Tos" abgekürzt.

Die Reaktion beginnt durch die Deprotonierung von TosMIC 1 unter Bildung eines Carbanions, das durch die benachbarten Sulfonyl- und Isonitrilgruppen stabilisiert ist. Das Carbanion greift nukleophil das Carbonylkohlenstoffatom des Acetons an. Es erfolgt über Elektronenwanderungen ein Ringschluss, so dass die Zwischenstufe 2 entsteht. Dieses reagiert über eine Tautomerie und Ringöffnung zur reaktiven Zwischenstufe 3.

Im nächsten Schritt wird der Tosylrest von der offenkettigen Zwischenstufe 3 abgespalten. Daraufhin kommt es am Carbonylkohlenstoffatom zum Angriff eines nukleophilen Teilchens (beispielsweise eines Aloholats). Aus einer anschließenden Eliminierungsreaktion geht die Zwischenstufe 4 hervor, die durch Protonierung zum Endprodukt, dem Isobutyronitril, reagiert.
Einzelnachweise
- In memory of Prof. Dr. Albert van Leusen. 13. Januar 2020, abgerufen am 1. Februar 2021 (englisch).
- Otto Oldenziel, Daan van Leusen, Albert van Leusen: Chemistry of sulfonylmethyl isocyanides. 13. A general one-step synthesis of nitriles from ketones using tosylmethyl isocyanide. Introduction of a one-carbon unit. In: J. Org. Chem. 42. Jahrgang, Nr. 19. American Chemical Society, 1977, S. 3114–3118, doi:10.1021/jo00439a002.
- Daan van Leusen, Albert van Leusen: Synthetic Uses of Tosylmethyl Isocyanide (TosMIC). In: Organic Reactions. 57. Jahrgang, Nr. 3, 2004, S. 417–666, doi:10.1002/0471264180.or057.03.