Valinol
Valinol ist eine chemische Verbindung aus der Gruppe der chiralen 1,2-Aminoalkohole. Valinol kann aus der Aminosäure Valin gewonnen werden, weshalb es zumeist, wie auch Valin, enantiomerenrein in der (S)-Konfiguration vorliegt. Das Enantiomer (R)-Valinol und das racemische (RS)-Valinol besitzen nur geringe Bedeutung.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
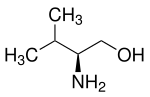 | |||||||||||||||||||
| (S)-Valinol | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Valinol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H13NO | ||||||||||||||||||
| Kurzbeschreibung |
weiße bis blass gelbe Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 103,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt |
30–32 °C[2] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
(S)-Valinol kann durch Reduktion von (S)-Valin mit Lithiumaluminiumhydrid oder Boran-Dimethylsulfid-Komplex hergestellt werden.[3] Alternativ kann Natriumborhydrid/Iod verwendet werden.[4]
Optisch reines (ee > 99 %) Valinol kann durch die Umsetzung des prochiralen Hydroxyketons mit ω-Transaminasen (ω-TA) mit einem Aminodonator (bspw. Isopropylamin) in organischen Lösungsmitteln, wie MTBE, erhalten werden.[5] Beste Ergebnisse erzielen ω-TAs aus Arthrobacter.[6]
Verwendung
(S)-Valinol kann in der Synthese von enantiomerenreinen Oxazolin-Katalysatoren[7] und Imidazolidinon-Auxiliaren für asymmetrische Aldol-Reaktionen verwendet werden.[8]
Einzelnachweise
- Eintrag zu L-Valinol bei TCI Europe, abgerufen am 22. Dezember 2022.
- Datenblatt L-Valinol bei Sigma-Aldrich, abgerufen am 21. Dezember 2022 (PDF).
- D. A. Dickman, A. I. Meyers, G. A. Smith, R. E. Gawley: REDUCTION OF α-AMINO ACIDS: L-VALINOL In: Organic Syntheses. 63, 1985, S. 136, doi:10.15227/orgsyn.063.0136; Coll. Vol. 7, 1990, S. 530 (PDF).
- Marc J. McKennon, A. I. Meyers, Karlheinz Drauz, Michael Schwarm: A convenient reduction of amino acids and their derivatives. In: The Journal of Organic Chemistry. Band 58, Nr. 13, 1993, S. 3568–3571, doi:10.1021/jo00065a020.
- Christine S. Fuchs, Robert C. Simon, Waander Riethorst, Ferdinand Zepeck, Wolfgang Kroutil: Synthesis of (R)- or (S)-valinol using ω-transaminases in aqueous and organic media. In: Bioorganic & Medicinal Chemistry. 22, 2014, S. 5558, doi:10.1016/j.bmc.2014.05.055.
- Rafael Luque, Frank Leung-Yuk Lam: Sustainable Catalysis. Energy-Efficient Reactions and Applications John Wiley & Sons, 2018 ISBN 978-3-527-33867-2, S. 97.
- Helen A. McManus, Patrick J. Guiry: Recent Developments in the Application of Oxazoline-Containing Ligands in Asymmetric Catalysis. In: Chemical Reviews. Band 104, Nr. 9, 2004, S. 4151–4202, doi:10.1021/cr040642v.
- Taek Hyeon Kim, Gue-Jae Lee: l-Valinol and l-phenylalaninol-derived 2-imidazolidinones as chiral auxiliaries in asymmetric aldol reactions. In: Tetrahedron Letters. Band 41, Nr. 10, 2000, S. 1505–1508, doi:10.1016/S0040-4039(99)02325-4.
