Tularämie
Tularämie ist eine häufig tödlich verlaufende ansteckende Erkrankung bei frei lebenden Nagetieren und Hasenartigen, die durch das Bakterium Francisella tularensis (früher Pasteurella tularensis) ausgelöst wird. Die Erkrankung ist eine Zoonose und kann auf den Menschen übertragen werden. Sie zählt in Deutschland zu den meldepflichtigen Tierkrankheiten.
| Klassifikation nach ICD-10 | |
|---|---|
| A21.- | Tularämie |
| A21.0 | Ulzeroglanduläre Tularämie |
| A21.1 | Okuloglanduläre Tularämie |
| A21.2 | Pulmonale Tularämie |
| A21.3 | Gastrointestinale Tularämie
Abdominale Tularämie |
| A21.7 | Generalisierte Tularämie |
| A21.8 | Sonstige Formen der Tularämie |
| A21.9 | Tularämie, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
Da das Beschwerdebild (mit Primäraffekt an der Eintrittsstelle und Beteiligung der regionären Lymphknoten) dem der Pest ähnelt und die Erkrankung sehr häufig Hasen und Wildkaninchen befällt, wird sie häufig auch als Hasenpest bezeichnet. Andere Namen sind Nagerpest, Lemmingfieber, Parinaudkrankheit und Hirschfliegenfieber.
Geschichte
Erstmals wurde die Erkrankung 1911 durch den US-amerikanischen Mediziner George W. McCoy beschrieben.[1] 1912 gelang ihm zusammen mit Charles W. Chapin die Isolierung des Erregers aus einer Eichhörnchenart in Kalifornien.[2][3] Zwischen 1919 und 1928 beschäftigte sich Edward Francis sehr ausführlich mit der Erkrankung und benannte sie nach dem Ort Tulare in Kalifornien/USA. Der wissenschaftliche Name des Erregers wurde ebenfalls nach ihm benannt. In Europa wurde die Tularämie zum ersten Mal 1931 dokumentiert, und zwar an der Ostseeküste Mittelschwedens. Zwischen 1936 und 1950 gelang den sowjetischen Wissenschaftlern Nikolai A. Gaiski, Boris J. Elbert, Somow und Chatenever die Entwicklung eines Impfstoffes gegen die Tularämie.
Während des Zweiten Weltkrieges wurden an der osteuropäischen Front Epidemien mit mehr als Hunderttausend Infektionen gemeldet. Der ehemalige sowjetische Biowaffenforscher Ken Alibek von der sowjetischen Behörde Biopreparat vermutet, dass die Epidemien die Folge eines Einsatzes von Francisella tularensis als biologische Waffe waren.[4] Der Seuchenhistoriker Stefan Winkle, der während des Zweiten Weltkrieges als Mitarbeiter des Robert-Koch-Instituts selbst mit den wiederholten Tularämieausbrüchen an der Ostfront befasst war, hält die Ansicht Alibeks jedoch für unhaltbar. Die Ausbrüche seien vielmehr Folge der ungeheuren Mäuseplage, die in dem endemisch tularämieverseuchten Gebiet infolge kriegsbedingt nicht abgeernteter Getreidefelder entstanden war. Der ungewöhnlich hohe Anteil an Lungentularämie sei darauf zurückzuführen, dass Soldaten auf verseuchten Strohmatten und Strohlagern schliefen und sich dabei infizierten.[5]
Der deutsche Spezialist für biologische Kriegsführung Heinrich Kliewe erhielt 1942 Berichte von Gefangenen, dass alle sowjetischen Soldaten im Raum Stalingrad gegen Tularämie geimpft worden seien. Kliewe ließ darauf 3.000 Liter Impfstoff im I.G. Farben-Werk in Marburg produzieren, genug für eine Million Soldaten. Dieser wurde auch an die Front gebracht, kam aber nicht zum Einsatz.[6]
In den 1950er und 1960er Jahren entwickelte das US-Militär Waffensysteme, die das Bakterium als Aerosol verteilen sollten. 1969 schätzte ein Expertengremium der Weltgesundheitsorganisation, dass eine derartige Verteilung von 50 Kilogramm F. tularensis über einer Stadt mit 5 Millionen Einwohnern in 250.000 Kampfunfähigen und 19.000 Toten resultieren würde.[4] 1997 schätzten Wissenschaftler der amerikanischen CDC die Folgekosten eines solchen Angriffs auf 5,4 Milliarden US-Dollar pro 100.000 dem Agens ausgesetzten Personen.[7]
Der größte dokumentierte Tularämie-Ausbruch fand 1966–1967 in einem Farmgebiet Schwedens statt und betraf etwa 600 Patienten. Diese hatten sich überwiegend beim Umschichten infizierten Heus durch Inhalation mit dem milderen Typ B infiziert und sprachen gut auf Tetracyclin an, sodass keine Todesfälle verzeichnet wurden.[4]
Erreger

Der Erreger der Tularämie ist das hochansteckende Bakterium Francisella tularensis (früher auch: Pasteurella tularensis). Es handelt sich um ein sehr kleines, gramnegatives, kokkoides, sporenloses, schwer anzüchtbares Stäbchen, das den γ-Proteobakterien zugeordnet wird. Francisella ist die einzige Gattung in der Familie der Francisellaceae, Ordnung Thiotrichales. Sie umfasst insgesamt 4 Spezies (F. tularensis, F. philomiragia, F. novicida und F. noatunensis). Das Bakterium wird durch Wärme und die herkömmlichen Desinfektionsmittel zerstört, ist aber gegenüber Kälte resistent. Bereits 10 bis 50 Bakterien als Aerosol können einen Menschen infizieren. Der Erreger kann in gefrorenem Hasenfleisch bis zu drei Jahre und in Boden und Wasser über mehrere Wochen überdauern.
Es sind mehrere Varianten bekannt:
- Francisella tularensis biovar tularensis (Typ A) in Nordamerika, der für gefährlichere Verläufe verantwortlich ist.
- Francisella tularensis biovar palaearctica (Typ B) mit weltweiter Verbreitung.
- Francisella tularensis biovar mediaasiatica mit Verbreitung in Kasachstan und Turkmenistan
- Francisella tularensis biovar novicida wurde mit wasserbedingten Ausbrüchen in Australien, Spanien und den USA in Verbindung gebracht.[8]
Verbreitung
- Nordamerika zwischen 30°N und 71°N: USA (vor allem Arkansas, Missouri, Oklahoma, Tennessee, Kansas und Utah, andere Bundesstaaten, außer Hawaii), Kanada und Mexiko – 1.500 Infektionen pro Jahr
- Asien, insbesondere Japan (1.400 Infektionen in 70 Jahren) und Teile Sibiriens
- Europa: insbesondere Skandinavien (20–50 pro Jahr), Tschechien (10), Slowakei (10), Spanien (55 Fälle seit 1997), Serbien (2001 bis März 2002 700 Fälle), Georgien und Deutschland (jährlich zwischen 3 und 15 Fällen; allerdings für Deutschland 2014 21 Fälle, 2015 34 Nachweise, 2016 41 Fälle, 2017 52 Nachweise. 2018 waren es 54 nachgewiesene Infektionen und 2019 stieg die Zahl auf 71. 2020 wurden 59 Fälle gezählt, 2021 waren es 113 und 2022 sank die Zahl auf 68. Für 2023 wurden Fälle 89 Fälle verzeichnet.)
Im Oktober 2005 infizierten sich bei einer Treibjagd auf Hasen im Landkreis Darmstadt-Dieburg neun Jäger und Treiber mit Tularämie. Fast alle waren am Ausnehmen oder Abbalgen beteiligt gewesen, sie hatten keine Krankheitszeichen an den Tieren festgestellt. Bei einem weiteren Jäger, der etwa vier Wochen später starb, wurde die Krankheit als Todesursache angenommen, da er typische Symptome gezeigt hatte. In Bayern wurde am 6. November 2018 bekannt, dass sich hier neun Jäger mit der Hasenpest infiziert haben.[9]
Kurz nach dem Zweiten Weltkrieg war die Krankheit in Deutschland wesentlich häufiger, vermutlich wegen der damals höheren Hasen- und Kaninchenpopulation und der stärkeren Nutzung dieser Tiere für die menschliche Ernährung. Rund 100 bis 200 Fälle wurden in dieser Zeit pro Jahr registriert.
Infektionsweg
Der Erreger befällt ein breites Spektrum von Lebewesen. Er infiziert vor allem verschiedene kleinere Säugetiere, wie Hasen und Mäuse, aber auch andere Wild- und Haustiere. Ebenso wurde der Erreger bei blutsaugenden Insekten wie Bremsen, Mücken oder Zecken und auch in Vögeln und Amphibien nachgewiesen.[10]
Der Erreger ist hochinfektiös. Bei Aufnahme über den Magen-Darm-Trakt reichen rund zehn Erreger, um eine Erkrankung auszulösen. Die Infektion kann über Haut- und Schleimhautkontakt von infektiösem Tiermaterial geschehen, bei der Jagd, dem Enthäuten oder der Schlachtung geschehen. Ebenso kann der Erreger über nicht ausreichend erhitztes Fleisch übertragen werden. Eine Infektion ist aber auch durch mit Tierkot verunreinigte Lebensmittel oder verunreinigtes Wasser möglich. Ein weiterer möglicher Infektionswegs ist das Einatmen von kontaminiertem Staub oder Aerosolen, zum Beispiel bei der Heubearbeitung. Außerdem können Stiche oder Bisse infizierter Insekten die Erkrankung auslösen.[10]
Eine Übertragung von erkrankten Menschen auf andere Menschen ist bisher nicht beschrieben, ist aber nicht mit Sicherheit auszuschließen. Bei vielen Erkrankungsfällen bleibt der Infektionsweg unklar.[10]
Krankheitsverlauf und Symptome
Die Tularämie verläuft bei Tieren und beim Menschen unterschiedlich.
Tularämie bei Tieren
Nach Übertragung der Erreger durch Parasiten auf die Nagetiere kommt es nach zwei bis drei Tagen zu einer Septikämie, also einer systemischen Infektion infolge dauerhafter Präsenz der Erreger im Blutkreislauf. Die Tiere fallen durch Schwäche, Apathie (bis zum Ausbleiben von Fluchtverhalten), Fieber und gesteigerte Atemfrequenz auf. Lymphknoten und Milz sind vergrößert. Innerhalb von vier bis dreizehn Tagen sind die meisten Tiere verendet. Chronisch verlaufende Infektionen enden nach 14 bis 60 Tagen tödlich.
Haushunde scheinen gegenüber dem Erreger weitgehend resistent zu sein. In seltenen Fällen kann es zu einem Krankheitsausbruch mit Fieber, Leber-, Milz- und Lymphknotenschwellung, Gelbsucht, Schnupfen, Bronchopneumonie und Haut und Schleimhautgeschwüren kommen.[11] Auch Hauskatzen scheinen nur wenig empfänglich zu sein. Bei ihnen können Fieber, Lymphknotenschwellungen, Fressunlust, Abmagerung und Schwäche auftreten. Bei mehrmaliger experimenteller Verfütterung von infektiösem Material starben die Tiere nach 10 bis 50 Tagen.[12]
Tularämie beim Menschen
Die Tularämie kann, meist über direkten Kontakt (etwa über kleine Hautdefekte), von lebenden oder toten Tieren auf den Menschen übertragen werden. Sie ist nach § 7 Infektionsschutzgesetz in Deutschland eine bei indirektem oder direktem Nachweis des Erregers meldepflichtige Zoonose. Der Verlauf der Erkrankung beim Menschen ist schwer und häufig lebensbedrohlich (die Letalität wird ohne Behandlung mit etwa 33 % angegeben), weshalb eine rechtzeitige Diagnosestellung von größter Bedeutung ist. In Mitteleuropa ist die Erkrankung sehr selten. In Deutschland wurden in den Jahren 2008 und 2009 insgesamt 15 bzw. 10 Fälle, im Jahr 2013 20 Fälle und 2014 21 Fälle gemeldet,[13][14][15] was einer Inzidenz von etwa 0,01 auf 100.000 entspricht. Im Herbst 2018 erkrankten mehrere Jäger nach einer Hasentreibjagd in Bayern an der Hasenpest. Mehrere Personen aus dem Umfeld der Jäger waren ebenfalls betroffen.[16] Aufgrund der Seltenheit der Erkrankung gibt die genaue Anamneseerhebung (Tierkontakt) meist den entscheidenden Hinweis für die Verdachtsdiagnose.
Die Inkubationszeit beträgt beim Menschen zwischen einem und zehn Tagen. Die Infektion kann über Kontakt mit infizierten Tieren[17] oder auch über Ektoparasiten (Mücken, Zecken) erfolgen. Je nach Eintrittspforte des Erregers (Hautwunde, über den Mund, Einatmen als Aerosol) kommt es zu unterschiedlichen Krankheitsmanifestationen, wie im Folgenden aufgeführt.
Äußere (lokalisierte) Formen
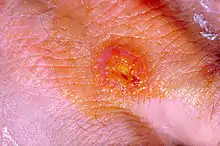
- ulzeroglanduläre (kutanoglanduläre) Tularämie – häufigste Form der Tularämie (75–85 %), die mit plötzlichem Fieberanstieg beginnt. Es bilden sich Geschwüre (Primäraffekte) an der Eintrittsstelle mit regionaler, oft eitriger Entzündung der Lymphknoten.
- okuloglanduläre Tularämie (Parinaudkonjunktivitis) – die Eintrittspforte an der Bindehaut des Auges ist durch ein gelbliches Knötchen erkennbar, die Lymphknoten vor dem Ohr und im Hals sind geschwollen. Zusätzlich kommt es zu einer sehr schmerzhaften Konjunktivitis.
- glanduläre Tularämie – es ist keine Eintrittspforte erkennbar und die Bildung von Geschwüren fehlt.
- glandulo-pharyngeale oder oropharyngeale Tularämie – diese Form ist vor allem bei Kindern anzutreffen. Es kommt zu Geschwüren in der Mundhöhle und im Rachen, die Lymphknoten im Kieferwinkel sind geschwollen.[18]
Innere (invasive) Formen
Die innere Form der Tularämie entsteht, wenn die Erreger eingeatmet werden oder auf dem Blutweg innere Organe erreichen. Es handelt sich dann um eine hochfieberhafte, gefährliche Erkrankung mit einer deutlich höheren Letalität als bei den äußeren Formen.
- typhöse (generalisierte oder septische) Tularämie – diese Form entsteht vor allem bei Laborinfektionen oder nach dem Kontakt mit infiziertem Schlachtblut; sehr oft sind die Lungen befallen, die Patienten leiden unter Fieber, Kopfschmerzen und Schweißausbrüchen. Es kommt zu Drüsenschwellungen, manchmal zu Hautausschlägen und zu einer Leukozytose.[19] Komplikationen sind Lungenabszesse, Mediastinitis, Meningitis, Perikarditis, Osteomyelitis, Rhabdomyolyse.
- intestinale Tularämie – Übertragung wahrscheinlich durch den Verzehr ungenügend erhitzten Fleisches infizierter Tiere. Symptome sind Pharyngitis, Übelkeit, Erbrechen, Durchfälle und abdominelle Schmerzen.
- thorakale (pulmonale) Tularämie – am zweithäufigsten; betrifft bevorzugt die Lunge und äußert sich dann als Pneumonie, also Lungenentzündung. Die Patienten leiden unter Husten mit Auswurf, Luftnot und Schmerzen im Brustkorb.
- abdominelle Tularämie – ein typhusähnliches Krankheitsbild, bei dem Leber und Milz geschwollen sind, die Patienten klagen über Bauchschmerzen und Durchfall.
Diagnose
Proben für den Erregernachweis sollten, wenn möglich, vor einer antibiotischen Therapie genommen werden. Der direkte Erregernachweis durch Anzucht auf cystein- oder cystinangereicherten, bluthaltigen Nährmedien (z. B. Cystein-Herz-Blutagar) aus Blut, Gewebeproben (Leber, Milz) oder Abstrichen gelingt nicht immer, sollte aber in jedem Fall versucht werden. Isolate sollten aus dem Routinelabor zur weiteren Charakterisierung an eines der unten genannten Speziallaboratorien übergeben werden.
Da Stämme von F. tularensis mit Antibiotikaresistenzen beschrieben sind, sollte standardmäßig eine Resistenztestung der angezüchteten Erreger durchgeführt werden. Da es sich um einen hochinfektiösen Erreger handelt, sollte die weiterführende Diagnostik, insbesondere Subtypisierung und Virulenz- und Resistenztestung Speziallaboratorien vorbehalten sein.
Als direkte Erregernachweise stehen auch Nukleinsäure-Nachweisverfahren (z. B. verschiedene PCR-Methoden) und Antigen-Nachweise (z. B. Immunofluoreszenzmikroskopie, ELISA) zur Verfügung.
Indirekt kann die Infektion durch den Nachweis von Serumantikörpern gegen den Erreger diagnostiziert werden. Ein einmalig hoher Titer oder ein Anstieg des Titers sprechen für eine vorangegangene Infektion. Für den Antikörpernachweis kommen verschiedene Methoden wie ELISA, Westernblot, Immunfluoreszenz und Agglutinationstest in Frage.[20]
Therapie
Die Behandlung besteht in der Gabe von Antibiotika. Am wirksamsten im Tierversuch hat sich Streptomycin gezeigt. Die Substanz wird aufgrund der häufigen Nebenwirkungen auf das Hör- und Gleichgewichtsorgan aber nicht mehr routinemäßig eingesetzt. Mittel der Wahl sind Fluorchinolone, allen voran Ciprofloxacin. Alternativ kann auch das Tetrazyklin Doxycyclin als Monotherapie verordnet werden.[21]
Bei schwerem Verlauf ist eine Kombinationstherapie bestehend aus Ciprofloxacin und Gentamicin empfohlen.[21]
Bei Schwangeren besteht durch die Antibiotika ein Risiko für die Schädigung des ungeborenen Kindes. Hier ist eine strenge Nutzen/Risiko-Abwägung notwendig. Alternativ kann nach Resistenztestung auf ein Makrolidantibiotikum ausgewichen werden.[21]
Prognose
Bei der inneren Form der Tularämie des Menschen handelt sich um eine schwere, lebensbedrohliche Erkrankung, die behandelt noch in ca. 5 % der Fälle tödlich verläuft. Ohne antibiotische Behandlung kann die Sterblichkeit über 30 % betragen. Mit einer Letalität von 10 bis 35 % ist die Virulenz amerikanischer Tularämieformen höher als die europäischen Stämme.
Bei Hunden ist die Prognose bei rechtzeitiger Behandlung gut. Wegen der großen Ansteckungsgefahr für den Besitzer ist eine Behandlung aber umstritten.[11]
Prophylaxe
Es existiert ein attenuierter Lebendimpfstoff, der in der UdSSR auch breit angewendet wurde. Dieser wird auch weiterhin in Russland eingesetzt. Ein für Laborpersonal in den USA eingesetzter Impfstoff wurde wegen begrenzter Wirksamkeit und möglichen Nebenwirkungen mittlerweile wieder vom Markt genommen. Da aufgrund der kurzen Inkubationszeit bereits vor Eintritt einer möglichen Impfwirkung die Krankheit ausbrechen kann, gelten Impfungen nach Exposition als nicht angezeigt.[10]
Eine medikamentöse Prophylaxe nach wahrscheinlicher Exposition (z. B. im Labor): Doxycyclin oder Ciprofloxacin sollte rasch begonnen werden. Falls eine mögliche Exposition erst nach Auftreten von Krankheitsfällen in Betracht gezogen wird, sollten alle mutmaßlich Exponierten ein Fieber-Monitoring für 14 Tage (nach der vermuteten Exposition) durchführen. Diejenigen, die in diesem Zeitraum eine grippeähnliche Erkrankung oder Fieber entwickeln, sollten therapiert werden, wie oben beschrieben.[10]
Das Überstehen der Erkrankung hinterlässt eine langjährige Immunität.
Meldepflicht
Tularämie ist in Österreich gemäß § 1 Abs. 1 Nummer 1 Epidemiegesetz 1950 bei Verdacht, Erkrankung und Tod anzeigepflichtig. Zur Anzeige verpflichtet sind unter anderen Ärzte und Labore (§ 3 Epidemiegesetz).
In der Schweiz besteht Meldepflicht bei positivem laboranalytischen Befund durch den behandelnden Arzt. Dies ergibt sich aus dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 1 bzw. Anhang 3 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen.
In Deutschland besteht gemäß § 7 IfSG eine namentliche Meldepflicht bei direktem oder indirektem Erregernachweis, soweit dieser auf eine akute Infektion hinweist.
Nach dem Recht Sachsens besteht eine namentliche Meldepflicht bezüglich Erkrankung und Tod an Tularämie.[22]
Literatur
- H. Krauss, A. Weber, M. Appel, B. Enders, A. v. Graevenitz, H. D. Isenberg, H. G. Schiefer, W. Slenczka, H. Zahner: Zoonosen. Von Tier zu Mensch übertragbare Infektionskrankheiten. 3. vollständig überarbeitete und erweiterte Auflage. Deutscher Ärzte-Verlag, Köln, 2004, ISBN 3-7691-0406-4.
- H. Krauss, A. Weber, M. Appel, B. Enders, A. v. Graevenitz, H. D. Isenberg, H. G. Schiefer, W. Slenczka, H. Zahner: Zoonoses. Infectious Diseases Transmissible from Animals to Humans. 3. Auflage. ASM Press American Society for Microbiology, Washington DC 2003, ISBN 1-55581-236-8.
- H. Krauss, A. Weber, B. Enders, H. G. Schiefer, W. Slenczka, H. Zahner: Zoonosen. ACATAP, Damaskus, Syrien 2001. (arabisch)
- Tularämie, Hasenpest (Francisella tularensis). In: Bundesgesundheitsblatt. Robert Koch-Institut 2001.
- Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich. 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 251 f.
- Karl Wurm, A. M. Walter: Infektionskrankheiten. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin / Göttingen / Heidelberg 1955; 2. Auflage ebenda 1961, S. 9–223, hier: S. 216–218.
Weblinks
- Tularämie – Informationen des Robert Koch-Instituts
- Beschreibung. Deutsche Gesellschaft für Reise- und Touristikmedizin
- Epidemiologisches Bulletin, 16. Dezember 2005 / Nr. 50. (PDF; 98 kB) RKI
- Francisella-tularensis-Infektionen durch Lebensmittel unwahrscheinlich. (PDF; 102 kB) Bundesinstitut für Risikobewertung (BfR) Risikobewertung und Schutzmaßnahmen, 18. Juni 2018.
- Webseite des Konsiliarlabors für Tularämie, Institut für Mikrobiologie der Bundeswehr, München
- Deutsches Referenzlabor für Tularämie am Friedrich-Loeffler-Institut Greifswald mit ausführlichen Informationen (Veterinärbakteriologie)
Einzelnachweise
- GW. McCoy: A plague-like disease of rodents. In: Public Health Bull, 1911, 43, S. 53–71.
- A. Tärnvik1, L. Berglund: Tularaemia. In: Eur Respir J, 2003, 21, S. 361–373.
- GW. McCoy, CW. Chapin: Bacterium tularense, the cause of a plaguelike disease of rodents. In: Public Health Bull, 1912, 53, S. 17–23.
- D. T. Dennis u. a.: Tularemia as a Biological Weapon. In: Journal of the American Medical Association. Band 21, Nr. 285, 2001, S. 2763–2773, PMID 11386933.
- Stefan Winkle: Die Geschichte der Seuchen. Berlin, 2021, S. 1155–1166
- Chris Bellamy: Absolute War. Soviet Russia in the Second World War: a modern history. London 2007, S. 545 f.
- A. F. Kaufmann, M. I. Meltzer, G. P. Schmid: The Economic Impact of a Bioterrorist Attack: Are Prevention and Postattack Intervention Programs Justifiable? In: Emerging Infectious Diseases. Band 3, Nr. 2, 1997 (cdc.gov).
- Tina Broman, Mats Forsman, Jeannine Petersen, Anders Sjöstedt: The Infectious Agent. in WHO Guidelines on Tularaemia. Genf, 2007, S. 4 (online mehrsprachig verfügbar)
- Bayern: Neun Jäger offenbar an Hasenpest erkrankt. Spiegel Online, 7. November 2018, abgerufen am 7. November 2018.
- RKI Ratgeber: Tularämie, Stand: 23. Februar 2016; abgerufen am 17. Juli 2023
- Katrin Hartmann: Tularämie. In: Peter F. Suter, Hans G. Niemand (Hrsg.): Praktikum der Hundeklinik. 10. Auflage. Paul-Parey-Verlag, Stuttgart 2006, ISBN 3-8304-4141-X, S. 312.
- In: Marian C. Horzinek u. a. (Hrsg.): Krankheiten der Katze. 4. Auflage. Enke, 2005, ISBN 3-8304-1049-2, S. 184.
- Epidemiologisches Bulletin, Nr. 15. (PDF; 267 kB) Robert Koch-Institut, 19. April 2010; mit Jahresstatistik meldepflichtiger Infektionskrankheiten 2008 und 2009.
- Nr. 31. (PDF) In: Epidemiologisches Bulletin. Robert Koch-Institut, 4. August 2014, abgerufen am 4. Dezember 2014.
- Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 307 kB) 19. Januar 2015.
- Bestätigt: Jäger in Nabburg an Hasenpest erkrankt. In: BR24. (br.de [abgerufen am 12. November 2018]).
- Fallbericht über Tularämie nach Katzenbiss: A. N. Weinberg, J. A. Branda: A 29-Year-Old Woman with Fever after a Cat Bite. (PDF) In: N Engl J Med. 2010; 363, S. 1560–1568, 14. Oktober 2010.
- Fallbericht: E. Capka, M. Roch, M. Ritter, U. Stölzel: 23-jähriger Patient mit Halsschmerzen und progredienter Lymphknotenschwellung – Eine seltene Form der Hasenpest. In: Der Internist. Band 51, Nr. 6, S. 784–787, doi:10.1007/s00108-009-2547-z.
- Karl Wurm, A. M. Walter: Infektionskrankheiten. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin / Göttingen / Heidelberg 1955; 2. Auflage ebenda 1961, S. 9–223, hier: S. 131 (Tularämie (typhöse Form)).
- Tularämie. In: Infektionskrankheiten A-Z. RKI, abgerufen am 15. Juni 2020.
- Hinweise zur Therapie der Tularämie. (PDF; 307 kB) Ständiger Arbeitskreis der Kompetenz- und Behandlungszentren für Krankheiten durch hochpathogene Erreger am Robert Koch-Institut, Stand: Oktober 2021; abgerufen am 7. Januar 2022
- Verordnung des Sächsischen Staatsministeriums für Soziales und Verbraucherschutz über die Erweiterung der Meldepflicht für übertragbare Krankheiten und Krankheitserreger nach dem Infektionsschutzgesetz. Vollzitat: Verordnung des Sächsischen Staatsministeriums für Soziales und Verbraucherschutz über die Erweiterung der Meldepflicht für übertragbare Krankheiten und Krankheitserreger nach dem Infektionsschutzgesetz vom 3. Juni 2002 (SächsGVBl. S. 187), die zuletzt durch die Verordnung vom 9. November 2012 (SächsGVBl. S. 698) geändert worden ist. In: revosax.sachsen.de. Staatsministerin für Soziales, abgerufen am 16. November 2020 (Fassung gültig ab: 16. Dezember 2012).