Tschitschibabin-Reaktion
Die Tschitschibabin-Reaktion (auch Tschitschibabin-Amin-Reaktion) ist eine nukleophile aromatische Substitutionsreaktion zur Herstellung von 2-, 4-Aminopyridinen oder -chinolinen und wurde erstmals 1914 von Alexei Jewgenjewitsch Tschitschibabin beschrieben. Dabei wird in einem für nukleophile Angriffe aktivierten Heteroaromaten, deren Elektronendichte durch induktive und mesomere Effekte herabgesetzt ist, ein Wasserstoffatom substituiert und somit dieser direkt aminiert.
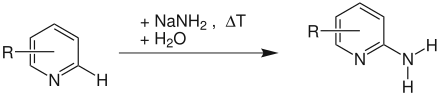
Tschitschibabin Übersichtsreaktion
Mechanismus
Die Reaktion (hier am Beispiel der Synthese von in ortho-, meta- oder para-Stellung mit dem Rest R substituierten 2-Aminopyridin) verläuft nach einem Additions-Eliminierungs-Mechanismus:
- Im ersten Schritt wird das aus dem Natriumamid stammende Amidion an das Kohlenstoffatom angelagert, wobei die negative Ladung durch den Stickstoff stabilisiert wird.
- Im nächsten Schritt erfolgt die Abspaltung eines Hydridions, das anschließend von der Aminogruppe zu Wasserstoff protoniert wird.
- Zum Schluss wird das 2-Aminopyridin durch Zugabe von Wasser aus seinem Anion freigesetzt.[1]
 Tschitschibabin
Tschitschibabin
Literatur
- Jie Jack Li, (Foreword by E. J. Corey): Name Reactions in Heterocyclic Chemistry II, Wiley-Verlag, 2011, ISBN 978-0-470-08508-0.
Quellen
- Eintrag zu Tschitschibabin-Synthesen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 16. Juni 2014.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.