Transaldolase
Transaldolase (TAL) (Gen: TALDO1) heißt das Enzym, welches die Übertragung eines C3-Körpers von Sedoheptulose-7-phosphat auf D-Glycerinaldehyd-3-phosphat und umgekehrt ermöglicht. Dieses Reaktionsgleichgewicht ist ein wichtiger Teil des Pentosephosphatwegs in allen Lebewesen.
| Transaldolase | ||
|---|---|---|
 | ||
|
Vorhandene Strukturdaten: 1f05 | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 337 Aminosäuren | |
| Bezeichner | ||
| Gen-Name | TALDO1 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.2.1.2, Transferase | |
| Reaktionsart | Übertragung eines CHOH-Rests | |
| Substrat | Sedoheptulose-7-phosphat + D-Glycerinaldehyd-3-phosphat | |
| Produkte | D-Erythrose-4-phosphat + D-Fructose-6-phosphat | |
| Vorkommen | ||
| Homologie-Familie | Transaldolase | |
| Übergeordnetes Taxon | Lebewesen | |
Mutationen können die (seltene) Erbkrankheit Transaldolasemangel bedingen.
Katalysiertes Gleichgewicht
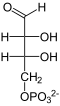 | D-Erythrose-4-phosphat | + |  | D-Fructose-6-phosphat |
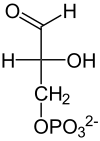 |
D-Glycerinaldehyd-3-phosphat | + | 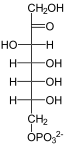 |
D-Sedoheptulose-7-phosphat |
Physiologische Wirkungen
Die Regulation der Genexpression im TALDO1-Gen kann den Glutathionspiegel und die Sensitivität von Zellen für Apoptose beeinflussen.[1]
Erkrankungen
Manche multiple-Sklerose-Patienten besitzen Antikörper gegen Bereiche der Transaldolase.[2]
Transaldolasemangel
Mutationen im TALDO1-Gen können zur (seltenen) Erbkrankheit des Transaldolasemangels und dieser zu Leberzirrhose führen.[3] Auch Multiorganversagen kann bei Transaldolasemangel auftreten.[4]
Andere Gendefekte
Varianten des Enzyms sind möglicherweise mit Plattenepithelkarzinom assoziiert.[5][6][7]
Anwendung
Unterscheidungen des bakteriellen Transaldolase-Gens mittels Polymerase-Kettenreaktion werden genutzt, eine Darmbesiedelung durch Bifidobacterium zu identifizieren und zu quantifizieren.[8]
Weblinks
- [ reactome.org: https://reactome.org/content/detail/R-HSA-71334 sedoheptulose 7-phosphate + D-glyceraldehyde 3-phosphate ⇔ D-erythrose 4-phosphate + D-fructose 6-phosphate]
Einzelnachweise
- Katalin Banki, Eliza Hutter, Emanuela Colombo, Nick J. Gonchoroff, Andras Perl: Glutathione levels and sensitivity to apoptosis are regulated by changes in transaldolase expression. In: Journal of Biological Chemistry. Band 271, Nr. 51, 1996, S. 32994–33001, doi:10.1074/jbc.271.51.32994.
- Niland B, Banki K, Biddison WE, Perl A: CD8+ T cell-mediated HLA-A*0201-restricted cytotoxicity to transaldolase peptide 168-176 in patients with multiple sclerosis. In: J. Immunol. 175. Jahrgang, Nr. 12, Dezember 2005, S. 8365–8378, PMID 16339578.
- Nanda M. Verhoeven, Jojanneke H.J. Huck, Birthe Roos, Eduard A. Struys, Gajja S. Salomons, Adriaan C. Douwes, Marjo S. van der Knaap, Cornelis Jakobs: Transaldolase deficiency: liver cirrhosis associated with a new inborn error in the pentose phosphate pathway. In: The American Journal of Human Genetics. Band 68, Nr. 5, 2001, S. 1086–1092, doi:10.1086/320108.
- Vassili Valayannopoulos, Nanda M. Verhoeven, Karine Mention, Gajja S. Salomons, Danièle Sommelet, Marie Gonzales, Guy Touati, Pascale de Lonlay, Cornelis Jakobs, Jean-Marie Saudubray: Transaldolase deficiency: a new cause of hydrops fetalis and neonatal multi-organ disease. In: The Journal of Pediatrics. Band 149, Nr. 5, 2006, S. 713–717, doi:10.1016/j.jpeds.2006.08.016.
- UniProt P37837
- Qian Y, Banerjee S, Grossman CE, et al: Transaldolase deficiency influences the pentose phosphate pathway, mitochondrial homoeostasis and apoptosis signal processing. In: Biochem. J. 415. Jahrgang, Nr. 1, Oktober 2008, S. 123–34, doi:10.1042/BJ20080722, PMID 18498245.
- Basta PV, Bensen JT, Tse CK, Perou CM, Sullivan PF, Olshan AF: Genetic variation in Transaldolase 1 and risk of squamous cell carcinoma of the head and neck. In: Cancer Detect. Prev. 32. Jahrgang, Nr. 3, 2008, S. 200–208, doi:10.1016/j.cdp.2008.08.008, PMID 18805652.
- Teresa Requena, Jeremy Burton, Takahiro Matsuki, Karen Munro, Mary Alice Simon, Ryuichiro Tanaka, Koichi Watanabe, Gerald W. Tannock: Identification, detection, and enumeration of human Bifidobacterium species by PCR targeting the transaldolase gene. In: Applied and Environmental Microbiology. Band 68, Nr. 5, 2002, S. 2420–2427, doi:10.1128/AEM.68.5.2420-2427.2002.