Topizität
In der Stereochemie bezeichnet die Topizität (von Topografie, griechisch τόπος tópos, deutsch ‚Orts-, Lagebeschreibung‘) die Lagebeziehung identischer funktioneller Gruppen oder Atome (sprich Substituenten) innerhalb eines Moleküls relativ zueinander.[1] Abhängig von der Beziehung können solche Gruppen homotop, enantiotop, oder diastereotop sein. Man spricht von Homotopizität, Enantiotopizität, oder Diastereotopizität.[2]
Homotopizität
Homotope Gruppen in chemischen Verbindungen sind identische Gruppen, die eine gleiche chemische Umgebung besitzen. Homotope Substituenten können durch Drehung um eine Cn-Achse ineinander überführt werden (Symmetrie-Kriterium[3]). Man bezeichnet Gruppen oder Atome als homotop, wenn das Molekül beim Ersetzen beider Gruppen achiral bleibt, oder sich eine bestehende Chiralität nicht ändert. Durch die Substitution entsteht kein Chiralitätszentrum (also auch kein Enantiomer, Substitutions-Kriterium[3]). Typische Beispiele sind die beiden Wasserstoffatome in Dibrommethan oder die Wasserstoffatome in Methylgruppen. Im Dibrommethan sind beispielsweise die beiden Wasserstoffatome homotop. Sie können durch Drehung um 180° entlang der C2-Achse (rot) ihre Position tauschen, ohne dass sich ihre Umgebung ändert.[4]
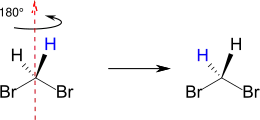
Homotope Atome oder Gruppen haben aufgrund ihrer gleichen Resonanzfrequenz eine identische chemische Verschiebung in der Kernspinresonanzspektroskopie (NMR) und sind somit isochron.
Heterotopizität
Sind zwei identische funktionelle Gruppen oder Atome nicht homotop, so bezeichnet man sie als heterotop. Heterotope Gruppen besitzen also eine unterschiedliche Umgebung. Diese untergliedern sich in konstitutop (andere Struktur bzw. Konstitution) oder stereoheterotop (andere räumliche Anordnung). Die Heterotopizität setzt sich aus Enantiotopizität und Diastereotopizität zusammen.
Enantiotopizität
Der stereochemische Begriff enantiotop bezieht sich auf zwei identische Gruppen, die, wenn man eine der beiden ersetzt, Enantiomere ergeben würden. Hierbei entsteht ein Chiralitätszentrum; daher werden diese Verbindungen auch als prochiral bezeichnet. Enantiotope Gruppen lassen sich nur durch eine Symmetrieebene oder ein Inversionszentrum i ineinander überführen, nicht jedoch durch Drehung um eine Cn-Achse.[4]
Zum Beispiel sind die beiden Wasserstoffatome enantiotop, die an das zweite Kohlenstoffatom von Butan gebunden sind. Butan besitzt als Symmetrieelement eine Spiegelebene entlang der Kohlenstoffkette. Ersetzt man eines dieser Wasserstoffatome durch Brom, so entsteht (R)-2-Brombutan. Ersetzt man das andere Wasserstoffatom durch Brom, so entsteht das Enantiomer, also (S)-2-Brombutan.
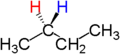 | 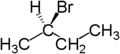 | 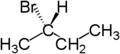 |
| Butan | (R)-2-Brombutan | (S)-2-Brombutan |
Auch enantiotope Atome oder Gruppen haben die gleiche chemische Verschiebung in der Kernspinresonanzspektroskopie. (Solange in einer nicht-chiralen Umgebung gemessen wird).
Diastereotopizität
Der stereochemische Begriff diastereotop bezieht sich auf die Stellung zweier Gruppen, die, wenn man eine von beiden ersetzt (substituiert), Diastereomere ergeben.[4] Zum Beispiel sind die zwei Wasserstoffatome am dritten Kohlenstoffatom von (S)-2-Brombutan diastereotop. Ersetzt man eines der Wasserstoffatome (im Bild blau dargestellt) durch Brom, so entsteht das eine Diastereomer (2S,3R)-2,3-Dibrombutan. Ersetzt man das andere Wasserstoffatom (im Bild rot dargestellt) durch Brom, so entsteht das andere Diastereomer, (2S,3S)-2,3-Dibrombutan.
 | 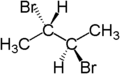 | 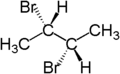 |
| (S)-2-Brombutan | (2S,3R)-2,3-Dibrombutan | (2S,3S)-2,3-Dibrombutan |
Diastereotope Atome oder Gruppen können in der Kernspinresonanzspektroskopie (NMR) unterschiedliche Verschiebungen zeigen, je nachdem, wie stark der Einfluss der chiralen Umgebung auf die beiden Atome oder Gruppen ist. Entscheidend dafür sind der Abstand der diastereotopen Gruppen vom Chiralitätszentrum und die konformative Flexibilität des Moleküls. Diastereotope Atome in relativ konformationsstabilen Molekülen mit mehreren nahegelegenen Stereozentren zeigen oft auffällig große Unterschiede in der chemischen Verschiebung. Typische Beispiele dafür sind die CH2-Gruppe in Kohlenhydraten (Position 6 in Hexosen) und die Seitenkettenprotonen, allen voran die β-Protonen (HB), der Aminosäuren gefalteter Proteine.
Siehe auch
Einzelnachweise
- Karl-Heinz Hellwich: Stereochemie - Grundbegriffe, Springer Verlag, 2002, S. 84–87, ISBN 3-540-42347-8.
- Eberhard Breitmaier, Günther Jung: Organische Chemie, 7. Auflage, Thieme Verlag, 2012, S. 283–284, ISBN 978-3-13-541507-9.
- Siegfried Hauptmann, Gerhard Mann: Stereochemie, Spektrum Akademischer Verlag, 1996, S. 100–103, ISBN 3-86025-144-9.
- Joachim Buddrus, Bernd Schmidt: Grundlagen der Organischen Chemie, 5. Auflage, de Gruyter Verlag, Berlin, 2015, S. 137, ISBN 978-3-11-030559-3.