Tolylfluanid
Tolylfluanid ist eine organische chemische Verbindung, die als Wirkstoff in Fungiziden und Holzschutzmitteln enthalten ist.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
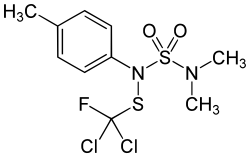 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tolylfluanid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H13Cl2FN2O2S2 | ||||||||||||||||||
| Kurzbeschreibung |
weißes, fast geruchloses Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 347,2 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,52 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt |
96 °C [1] | ||||||||||||||||||
| Siedepunkt |
ab 150 °C Zersetzung[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
sehr schwer in Wasser (0,9 mg·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Die Synthese von Tolylfluanid beginnt mit der Reaktion von Dimethylamin und Sulfurylchlorid. Das Produkt reagiert weiter mit p-Toluidin sowie mit Dichlorfluormethansulfenylchlorid zum Endprodukt.[4]
Aufnahme, Metabolisierung und Ausscheidung
Tolylfluanid reizt die Atemwege, den Magen-Darm-Trakt, Augen und Haut.[1]
Tolylfluanid wird schnell und nahezu vollständig aus dem Magen-Darm-Trakt resorbiert. Die höchsten Konzentrationen sind im Blut, Lunge, Leber, Nieren, Milz und Schilddrüse zu finden. 99 % werden innerhalb von zwei Tagen mit dem Urin ausgeschieden. Es gibt jedoch einige Akkumulation in der Schilddrüse.[5]
Umweltverhalten
Tolylfluanid hydrolysiert im sauren Bereich langsam. Die Halbwertszeit ist kürzer, wenn der pH-Wert hoch ist; bei pH = 7 beträgt sie über 2 Tage. In aerobem Milieu (pH = 7,7–8,0) zersetzt sich Tolylfluanid hydrolytisch und mikrobiell zu N,N-Dimethyl-N′-(4-methylphenyl)sulfamid (DMST) und Dimethylsulfamid. Nach 14 Tagen ist Tolylfluanid im Prinzip abgebaut. Die Halbwertszeit von DMST beträgt 50–70 Tage.[5]
Verwendung
Der Wirkstoff wird im Obst- und Zierpflanzenbau gegen Grauschimmelfäule (Botrytis), gegen die Kraut- und Braunfäule an Tomaten sowie bei Gurken gegen Echten Mehltau. Bei den Gemüsen muss danach eine Wartezeit von drei Tagen eingehalten werden.
Zulassung
In den EU-Staaten wie Deutschland und Österreich sowie in der Schweiz ist Tolylfluanid in keinem zugelassenen Pflanzenschutzmittel enthalten.[6]
Weblinks
- EPA Factsheet
- fluoridealert.org: Tolyfluanid
Einzelnachweise
- Eintrag zu Tolylfluanid (Gehalt an Partikeln mit einem aerodynamischen Durchmesser unter 50 µm >=0,1 Gew.-%) in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- Eintrag zu Tolylfluanid in der Pesticide Properties DataBase (PPDB) der University of Hertfordshire, abgerufen am 7. März 2014.
- Eintrag zu Dichloro-N-[(dimethylamino)sulphonyl]fluoro-N-(p-tolyl)methanesulphenamide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Thomas A. Unger: Pesticide Synthesis Handbook. William Andrew, 1996, ISBN 0-8155-1853-6, S. 985 (Vorschau).
- Svensk kemikalieinspektion: Tolylfluanid (Memento vom 27. September 2007 im Internet Archive) (PDF-Datei; 50 kB).
- Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Tolylfluanid in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs und Deutschlands, abgerufen am 3. März 2016.


