Thymolblau
Thymolblau ist ein Triphenylmethanfarbstoff und gehört zur Gruppe der Sulfonphthaleine. Es findet Verwendung als pH-Indikator. Sein Phthalein-Analogon ist das Thymolphthalein. Durch Bromierung kann das Bromthymolblau dargestellt werden.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
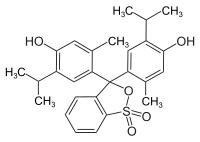 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Thymolblau | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C27H30O5S | ||||||||||||||||||
| Kurzbeschreibung |
grüner Feststoff mit phenolartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 466,59 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser (0,11 g·l−1 bei 25 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften
Physikalische Eigenschaften
Thymolblau ist ein grüner Feststoff mit phenolartigem Geruch und schmilzt bei 221 °C.[1]

Chemische Eigenschaften
Es liegen zwei Farbumschlagspunkte vor:[2]
- pH 1,2–2,8: Farbänderung von violettrot nach bräunlichgelb
- pH 8,0–9,6: Farbänderung von gelbgrünlich nach blau
Thymolblau enthält zwei Hydroxygruppen und einen wenig stabilen Sultonring. Im wässrigen Medium wird dieser Ring gespalten, und nach einer Umlagerung entsteht die chinoide gelb gefärbte Form des Farbstoffs. Im stark saurem Milieu (pH < 1,2) wird das chinoide System protoniert, die Lösung wird dadurch violettrot. Im basischen Milieu (pH = 8,0–9,6) wird die Hydroxygruppe deprotoniert und die Lösung färbt sich blau.
| Spezies | H2In | HIn− | In2− |
|---|---|---|---|
| Struktur | 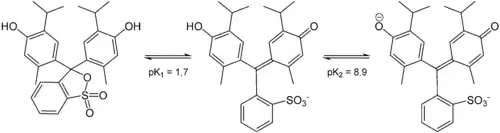 | ||
| pH | < 1,2 | 2,8–8,0 | > 9,6 |
| Farbe | violettrot | gelb | blau |
 | |||
Verwendung
Thymolblau wird bei Säure-Base-Titrationen als Indikator eingesetzt. Dabei wird meistens nur der zweite Umschlagsbereich (pH = 8,0–9,6) zur Indikation verwendet.
Einzelnachweise
- Datenblatt Thymolblau bei Merck, abgerufen am 20. Februar 2010.
- Datenblatt Thymol Blue bei Sigma-Aldrich, abgerufen am 12. Mai 2017 (PDF).
Weblinks
- www.chemieunterricht.de: Thymolblau.
- Webseite mit 3D-Modell des Moleküls