Thiosalicylsäure
Thiosalicylsäure ist ein Schwefelanalogon der Salicylsäure, wobei die phenolische Hydroxygruppe durch eine Thiolgruppe (Mercaptogruppe) ersetzt ist.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
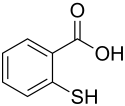 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Thiosalicylsäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C7H6O2S | |||||||||||||||||||||
| Kurzbeschreibung |
hellgelber, übelriechender Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 154,19 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Sublimationspunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Gewinnung und Darstellung
Die Synthese erfolgt durch die Reaktion von 2-Chlor- oder 2-Brombenzoesäure mit Natriumhydrogensulfid oder Kaliumhydrogensulfid in Gegenwart von Kupfer. Die Reduktion von Dithiosalicylsäure liefert ebenfalls Thiosalicylsäure.[3]
Eigenschaften
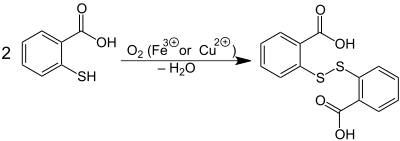
Luftsauerstoff oxidiert Thiosalycilsäure zu Dithiosalicylsäure (ein Disulfid). Dithiosalicylsäure bildet sich auch, wenn man eine alkoholische Lösung der Thiosalicylsäure mit Eisen(III)-chlorid versetzt. Die Reaktion wird z. B. auch durch Kupfer(II)-salze katalysiert.[4]
Verwendung
Der rein rote Küpenfarbstoff Thioindigo wurde erstmals aus Thiosalicylsäure synthetisiert.[5]
Einzelnachweise
- Eintrag zu THIOSALICYLIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. Mai 2020.
- Datenblatt Thiosalicylsäure bei Merck, abgerufen am 24. April 2011.
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, ISBN 978-0-911910-00-1, S. 1608.
- Mohammad Soleiman-Beigi, Zahra Taherinia: Simple and efficient oxidative transformation of thiols to disulfides using Cu(NO3)2·3H2O in H2O/AcOEt in Monatshefte für Chemie; 145, 2014, 1151–1154 doi:10.1007/s00706-014-1178-9.
- Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart 1984, ISBN 3-7776-0406-2, S. 696.
