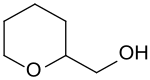
Tetrahydropyran-2-methanol
Tetrahydropyran-2-methanol ist ein sechsgliedriger heterocyclischer Ether, der in 2-Stellung eine Hydroxymethylgruppe trägt. Die Verbindung ist eine zentrale Zwischenstufe bei der Synthese von 1,6-Hexandiol[6] aus den nachwachsenden Rohstoffen Glycerin als C3-Baustein oder Hydroxymethylfurfural als C6-Baustein.[7]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Struktur ohne Angabe zur Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tetrahydropyran-2-methanol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H12O2 | ||||||||||||||||||
| Kurzbeschreibung |
klare, farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 116,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt |
< −70 °C[2] | ||||||||||||||||||
| Siedepunkt |
| ||||||||||||||||||
| Dampfdruck |
0,05 kPa bei 20 °C[3] | ||||||||||||||||||
| Löslichkeit |
vollständig in Wasser, Ethanol und Diethylether[4], sowie in Dichlormethan[5] löslich | ||||||||||||||||||
| Brechungsindex |
1,4570–1,4590 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Herstellung
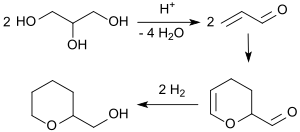
Glycerin wird beim Erhitzen mit Schwefelsäure auf > 300 °C bei Drücken > 25 MPa zu Acrolein dehydratisiert,[8] das in einer [4+2]-Cycloaddition zum Acrolein-Dimer dimerisiert. Die katalytische Hydrierung von Acrolein-Dimer führt zu Tetrahydropyran-2-methanol.[9]
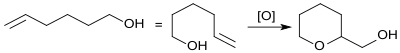
Die oxidative Cyclisierung von 5-Hexen-1-ol (aus 6-Chlorhexanol durch Flash-Pyrolyse bei 700 °C in 87%iger Ausbeute[10]) mit Wasserstoffperoxid in Gegenwart von Titansilikalit-Zeolith liefert THP-2M in einer Ausbeute von 88 %.[11]
1,2,6-Hexantriol reagiert unter Säurekatalyse mit Trifluormethansulfonsäure quantitativ unter Cyclisierung zu Tetrahydropyran-2-methanol.[12]
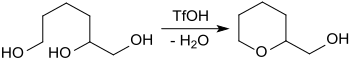
Eigenschaften
Tetrahydropyran-2-methanol ist eine klare farblose Flüssigkeit, die sich vollständig mit Wasser und mit vielen organischen Lösungsmitteln, wie z. B. Ethanol, Diethylether oder Methylenchlorid mischt.
Anwendungen
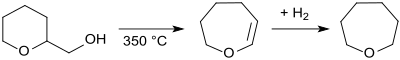
Tetrahydropyran-2-methanol kann in der Dampfphase durch Überleiten über einen Aluminiumsilikat-Kontakt bei 350 °C zu dem Vinylether 2,3,4,5-Tetrahydrooxepin dehydratisiert und an einem Nickel-Kontakt bei 110 °C zu Oxepan hydriert werden.[13]
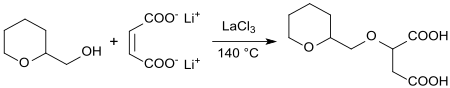
Lanthanchlorid LaCl3-induzierte Michael-Addition von THP-2M an Maleate erzeugt das entsprechende Bernsteinsäurederivat in 89%iger Ausbeute, die auf seine Eignung als Komplexbildner für Calcium-Ionen untersucht wurde.[14]
Bei der Hydrierung von Tetrahydropyran-2-methanol entstehen je nach Verfahrensbedingungen bei oft stark schwankenden Umsätzen unterschiedliche Produkte bzw. Produktgemische.[6][12]
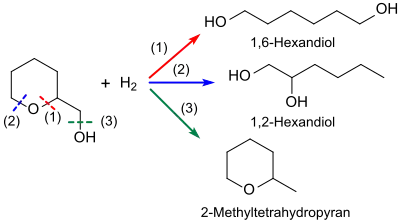
Zur gezielten Herstellung des als Diolkomponente in Polyestern und Polyurethanen interessanten 1,6-Hexandiols erscheint die Hydrierung mittels bifunktionellen Rhodium-Rhenium-RhRe-Katalysatoren auf Aktivkohle[15], Rh-RhOx/C-[6] oder Rh-RhOx/SiO2-Katalysatoren[12] aussichtsreich. Dabei können in stark verdünnten wässrigen Lösungen bei 100–120 °C und Reaktionsdauern von ca. 24 h hohe Selektivitäten (> 96 %) für 1,6-Hexandiol bei relativ niedrigen Umsätzen von 26 bis 36 % erzielt werden. Höhere Umsätze bei längeren Reaktionszeiten führen zu heterogenen Stoffgemischen. Nachteilig ist die meist uneinheitliche Zusammensetzung der Rhodium-Rhenium-Katalysatoren[15] und ihr hoher Preis.
Unlängst wurde eine alternative Route von Tetrahydropyran-2-methanol zu 1,6-Hexandiol ohne Verwendung teurer Edelmetallkatalysatoren berichtet.[16]
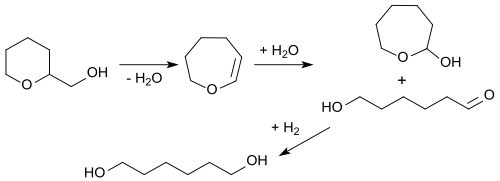
Dabei wird THP-2M an Zeolithen zu 2,3,4,5-Tetrahydrooxepin mit einer Ausbeute von 40 % dehydratisiert, dieses zu 2-Oxepanol und 6-Hydroxyhexanal hydratisiert (kombinierte Ausbeute von 85 %) und quantitativ an einem Nickel-Aktivkohle-Kontakt hydriert. Die 1,6-Hexandiol-Gesamtausbeute aus THP-2M beträgt dabei 34 %.
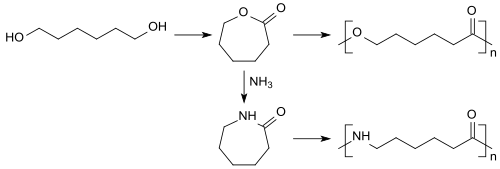
Das so aus nachwachsenden Rohstoffen gewonnene 1,6-Hexandiol kann oxidativ zu Caprolacton cyclisiert werden,[17] das zu dem biologisch abbaubaren Kunststoff Polycaprolacton bzw. mit Ammoniak zu dem wichtigeren Polyamid-Monomer ε-Caprolactam für Polycaprolactam umgesetzt werden kann.
Einzelnachweise
- Datenblatt Tetrahydropyran-2-methanol 98% bei Sigma-Aldrich, abgerufen am 6. April 2018 (PDF).
- Datenblatt 2-(Hydroxymethyl)tetrahydropyran 94% bei Alfa Aesar, abgerufen am 6. April 2018 (Seite nicht mehr abrufbar).
- Eintrag zu Tetrahydropyran-2-methanol bei TCI Europe, abgerufen am 6. April 2018.
- William M. Haynes: CRC Handbook of Chemistry and Physics, 96th Edition. CRC Press, Boca Raton, FL, U.S.A. 2015, ISBN 978-1-4822-6097-7, S. 3–502.
- J.P. Barnier, J. Champion, J.M. Conia: Cyclopropanecarboxaldehyde In: Organic Syntheses. 60, 1981, S. 25, doi:10.15227/orgsyn.060.0025; Coll. Vol. 7, 1990, S. 129 (PDF).
- K. Chen, S. Koso, T. Kubota, Y. Nakagawa, K. Tomishige: Chemoselective hydrogenolysis of tetrahydropyran-2-methanol to 1,6-hexanediol over rhenium-modified carbon-supported rhodium catalysts. In: ChemCatChem. Band 2, 2010, S. 547–555, doi:10.1002/cctc.201000018.
- K. Tomishige, Y. Nakagawa, M. Tamura: Production of Platform Chemicals from Sustainable Resources. In: Z. Fang, R.L. Smith, Jr., X. Qi (Hrsg.): Biofuels and Biorefineries. Band 7. Springer-Verlag, 2017, ISBN 978-981-10-4171-6, S. 364.
- M. Watanabe, T. Iida, Y. Aizawa, T.M. Aida, H. Inomata: Acrolein synthesis from glycerol in hot-compressed water. In: Bioresour. Technol. Band 98, Nr. 6, 2007, S. 1285–1290, doi:10.1016/j.biortech.2006.05.07.
- Patent US20160159715A1: Process for producing 1,6-hexandiol. Angemeldet am 2. Dezember 2015, veröffentlicht am 9. Juni 2016, Anmelder: E. I. Du Pont de Nemours and Co., Erfinder: R. J. Davis, C. A. Menning, J. E. Murphy, J. C. Ritter, S. K. Sengupta.
- L. W. Jenneskens, C. A. M. Hoefs, U. E. Wiersum: Preparative flash vacuum thermolysis. Selective elimination of 6-chloro-1-hexene from esters of 6-chloro-1-hexanol with Schoenberg rearrangement of the S-methyl xanthate. In: J. Org. Chem. Band 54, Nr. 24, 1989, S. 5811–5814, doi:10.1021/jo00285a030.
- A. Bhaumik, T. Tatsumi: Highly efficient and regioselective cyclization catalyzed by titanium silicate-1. In: Chem. Commun. Nr. 4, 1998, S. 463–464, doi:10.1039/A708528A.
- T. Buntara, S. Noel, P. H. Phua, I. Melián-Cabrera, J. G. de Vries, H. J. Heeres: From 5-hydroxymethylfurfural (HMF) to polymer precursors: Catalyst screening studies on the conversion of 1,2,6-hexanetriol to 1,6-hexanediol. In: Top. Catal. Band 55, Nr. 7–10, 2012, S. 612–619, doi:10.1007/s11244-012-9839-6.
- Patent US3636053: Preparation of 2,3,4,5-tetrahydrooxepin. Angemeldet am 1. April 1969, veröffentlicht am 18. Januar 1972, Anmelder: Monsanto Co., Erfinder: D.A. Tyssee.
- E. G. K. Quartey, J. A. Peters, H. van Bekkum, T. Anthonsen: LaIII-induced addition of tetrahydrofurfuryl alcohol, tetrahydropyran-2-ylmethanol, D-glucose, methanol and ethanol to maleate. In: Acta Chem. Scand. Band 50, 1996, S. 825–831, doi:10.3891/acta.chem.scand.50-0825.
- J. He et al.: Production of α, ω-diols from Biomass. (PDF) In: Thermal and Catalytic Sciences 2016. University of Wisconsin-Madison, 3. November 2016, abgerufen am 14. April 2018.
- S. P. Burt, K. J. Barnett, D. J. McClelland, P. Wolf, J. A. Dumesic, G. W. Huber, I. Hermans: Production of 1,6-hexanediol from tetrahydropyran-2-methanol by dehydration-hydration and hydrogenation. In: Green Chem. Band 19, 2017, S. 1390–1398, doi:10.1039/C6GC0360F.
- T. Buntara, S. Noel, P. H. Phua, I. Melián-Cabrera, J. G. de Vries, H. J. Heeres: Caprolactam from renewable resources: Catalytic conversion of 5-hydroxymethylfurfural into caprolactone. In: Angew. Chem. Band 123, Nr. 31, 2011, S. 7221–7225, doi:10.1002/ange.201102156.
