Tellur
Tellur [] (lat. tellus „Erde“) ist ein seltenes chemisches Element mit dem Elementsymbol Te und der Ordnungszahl 52. Im Periodensystem steht es in der sechsten Hauptgruppe, bzw. der 16. IUPAC-Gruppe, und 5. Periode und zählt damit zu den Chalkogenen. Seine Häufigkeit entspricht ungefähr der von Gold, mit dem es auch verschiedene Verbindungen eingeht, die in der Natur als Minerale auftreten. Kristallines Tellur ist ein silberweißes, metallisch glänzendes Halbmetall, das im Aussehen Zinn und Antimon ähnelt. Es reagiert spröde auf mechanische Belastung und kann daher leicht pulverisiert werden. In chemischen Verbindungen mit Nichtmetallen steht es in seinem Verhalten Schwefel und Selen nahe, in Legierungen und intermetallischen Verbindungen zeigt es jedoch sehr ausgeprägte (halb-)metallische Eigenschaften.
| Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Tellur, Te, 52 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Halbmetalle | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 16, 5, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silberweiß, metallisch glänzend | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 236-813-4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.033.452 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,01 ppm[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 127,60(3)[3] u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 140 (123) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 138 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 206 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Kr] 4d10 5s2 5p4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 9.009808(6) eV[4] ≈ 869.3 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 18.6(4) eV[4] ≈ 1795 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 27.84(4) eV[4] ≈ 2686 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 37.4155(12) eV[4] ≈ 3610.05 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 59.3(9) eV[4] ≈ 5722 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6. Ionisierungsenergie | 69.1(2,0) eV[4] ≈ 6667 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modifikationen | kristallin und amorph Hochdruckmodifikationen (kristallin) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | trigonal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 6,24 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 2,25 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch (χm = −2,4 · 10−5)[7] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 722,66 K (449,51 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 1263 K[8] (990 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 20,46 · 10−6 m3·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 114 kJ/mol[8] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 17,5 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 2610 m·s−1 bei 293,15 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 1 · 104 S·m−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 3 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | −2, (±1), 2, 4, 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −1,143 V (Te + 2 e− → Te2−)[10] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 2,1 (Pauling-Skala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Geschichte


Tellur wurde 1782 von dem österreichischen Chemiker und Mineralogen Franz Joseph Müller von Reichenstein (1740–1825) bei Untersuchungen von Gold-Erzen aus der Grube Mariahilf am Berg Faczebaja bei Zlatna (dt. Klein Schlatten, ung. Zalatna) nahe Sibiu (dt. Hermannstadt, Siebenbürgen, Rumänien) entdeckt, die eine geringere Goldausbeute als erwartet erbrachten. Er war durch die wissenschaftliche Abhandlung Nachricht vom gediegenen Spiesglaskönig in Siebenbürgen[14] – Spiesglaskönig bezeichnet gediegen Antimon, Spiesglas ist eine alte Bezeichnung für das Mineral Stibnit (Amntimonit, Grauspießglanz Sb2S3) – von Ignaz von Born (1742–1791) auf die Erze aufmerksam geworden. Von Born hielt das gediegene Metall in den Golderzen für Antimon und führte die geringe Ausbeute auf eine Verbindung des Goldes mit Antimon zurück. Müller von Reichenstein widersprach dieser Ansicht und hielt es zunächst für „geschwefelten Wismuth“.[15] Nach weiteren Untersuchungen, deren Ergebnisse er zwischen 1783 und 1785 in einer vierteiligen Abhandlung publizierte,[16] schloss er jedoch auch Bismut aus, da das Metall, im Gegensatz zu Antimon und Bismut, praktisch nicht mit Schwefelsäure reagierte. Er verlieh der metallischen Phase den Namen metallum problematicum (auch aurum problematicum beziehungsweise aurum paradoxum). Nach heutiger Erkenntnis besteht es neben gediegenem Tellur aus den Mineralen Nagyágit (Blättererz, AuPb(Pb,Sb,Bi)Te2–3S6) und Sylvanit (Schrifttellur, (Au,Ag)Te2). Müller von Reichenstein vermutete, dass metallum problematicum „…vielleicht ein neues bisher noch nicht gekanntes Halbmetall seye?“, wollte seine Befunde jedoch erst von dem schwedischen Mineralogen und Chemiker Torben Olof Bergman (1735–1784) bestätigen lassen. Im Jahr 1783 schickte er Proben des Erzes zur Begutachtung an Bergman, jedoch erhielt er keine definitiven Antworten. Bergman verstarb 1784 und die Untersuchungen an metallum problematicum wurden 1785 vorerst eingestellt.
Erst zwölf Jahre später, im Jahr 1797, erhielt Martin Heinrich Klaproth (1743–1817) in Berlin Proben der Erze von Müller von Reichenstein. Klaproth bekräftigte die Schlussfolgerungen aus Müller von Reichensteins Untersuchungen und sah genügend Hinweise für die Entdeckung eines neuen Elements. Im Januar 1798 würdigte Klaproth die Verdienste Müller von Reichensteins in einem Vortrag und schrieb ihm die Entdeckung des neuen Elements zu. Da Müller von Reichenstein dem Element keinen Namen gegeben hatte, entschied sich Klaproth für den Namen Tellur (lat. tellus: „Erde“):
„Zur Ausfüllung dieser bisherigen Lücke in der chemischen Mineralogie lege ich hier meine mit diesen kostbaren Erzen angestellten Versuche und Erfahrungen dar, deren Hauptresultat in der Auffindung und Bestätigung eines neuen eigenthümlichen Metalls besteht, welchem ich den von der alten Mutter Erde entlehnten Nahmen Tellurium beylege.“
Die originalen Handstücke des Probenmaterials von der Typlokalität Zlatna, das Klaproth zur Verfügung hatte, befinden sich heute im Museum für Naturkunde in Berlin.
Unabhängig von Müller von Reichenstein und Klaproth entdeckte 1789 der ungarische Chemiker und Botaniker Paul Kitaibel (1757–1817) das Tellur bei Untersuchungen von Golderzen aus dem Bergbauort Nagybörzsöny (Deutsch-Pilsen) in Ungarn. Klaproth erwähnte in seinem veröffentlichten Vortrag jedoch nur Müller von Reichenstein, obwohl er seit 1796 durch ein Manuskript Kitaibels auch Kenntnis von seinen Untersuchungen hatte. In einem Brief an Kitaibel erklärte Klaproth, der Inhalt des Manuskripts sei ihm entfallen und er habe bei den Untersuchungen der Erze Müller von Reichensteins keinen Zusammenhang mit seiner Arbeit gesehen. Klaproth überzeugte Kitaibel schließlich, dass die Entdeckung des Tellurs allein Müller von Reichenstein zugeschrieben werden sollte, da dieser bereits einige Jahre früher dieselben Beobachtungen an dem neuen Element machte.
Das Elementsymbol „Te“ wurde 1814 von Jöns Jakob Berzelius (1779–1848) vorgeschlagen und wird bis heute verwendet. Die erste Strukturaufklärung von kristallinem Tellur mit Hilfe der Röntgenbeugung an Pulverproben erfolgte 1924 in Manchester.[18]
Vorkommen
Tellur ist ein selten vorkommendes Element; sein Anteil an der Erdkruste beträgt ca. 0,01 ppm (g/t). Mit Gold, untergeordnet auch mit Silber, Kupfer, Blei und Bismut sowie den Platinmetallen kommt es selten gediegen, also in elementarer Form in der Natur, vor.
Gediegen Tellur gehört als Mineral zur Gruppe der Elemente, genauer der Halb- und Nichtmetalle und wird in der Systematik der Minerale nach Strunz unter der Nummer I/B.03-40 (8. Auflage) bzw. 1.CC.10 (9. Auflage), und nach Dana unter der Nummer 1.3.4.2 geführt.
Spuren bis hin zu größeren Mengen an Selen können in gediegen Tellur enthalten sein (Selentellur). Obwohl es sich bei Tellur um ein seltenes Element handelt, ist eine relativ große Anzahl von Mineralen bekannt, denn Tellur bildet eigene Minerale, weil es nur selten in Sulfiden oder Seleniden beziehungsweise Sulfaten oder Selenaten eingebaut wird; für diese Kristallgitter der leichteren Homologen ist es zu groß. Umgekehrt dagegen vertreten die beiden leichteren Homologen häufiger das Tellur auf seinen Gitterplätzen in Kristallstrukturen tellurhaltiger Minerale.
Tellur zeigt von allen Elementen die höchste Affinität zu Gold und findet sich daher in der Natur häufig in Form von Gold-Telluriden, Mineralen mit Tellurid- (Te2−) beziehungsweise Ditellurid-Anionen (Te22−). Neben Gold und anderen Edelmetallen bilden vor allem Blei und Bismut weitere natürliche Telluride, oft begleitend (Paragenesen) zu den gediegenen Metallen und Gold-Erzen.
Seltener sind Minerale mit Te4+-Kationen in der Kristallstruktur, wobei auch das wichtigste Oxid des Tellurs, das Tellurdioxid TeO2 in zwei Modifikationen als tetragonaler Paratellurit (α-TeO2) und orthorhombischer Tellurit (β-TeO2) in der Natur auftritt. Bei den weiteren Mineralen mit Tellur(IV)-Kationen handelt es sich um Oxotellurate(IV) (Tellurite), die komplexe [TeO3]2−- oder [TeO4]4−-Anionen enthalten. Minerale mit Te6+-Kationen in Form von oktaedrischen [TeO6]6−-Komplexanionen sind äußerst selten, es sind 21 Minerale bekannt, die größtenteils Kupfer und Blei enthalten. Neben den genannten Mineralen existieren in der Natur auch gemischtvalente Tellurminerale, darunter das Calcium-Oxotellurat(IV,VI) Carlfriesit CaTe3O8 mit einem Te4+:Te6+-Verhältnis von 2:1.[19][20] Bei den Mineralen mit Te4+ und Te6+-Kationen handelt es sich um Sekundärminerale, die aus der Verwitterung von gediegen Tellur und Telluriden entstanden sind.
Tellurhaltige Minerale sind für die technische Gewinnung von Tellur ohne Bedeutung, da sie zu selten vorkommen und praktisch keine abbauwürdigen Lagerstätten existieren. Zu den bekannten Fundorten von gediegen Tellur beziehungsweise tellurhaltiger Minerale zählen neben der Typlokalität Zlatna (Siebenbürgen, Rumänien) auch Moctezuma (Mexiko), Cripple Creek (Colorado), Kalgoorlie (Australien) und Calaveras (Kalifornien). Bisher (Stand: 2012) sind 154 tellurhaltige Minerale bekannt, von denen allerdings fünf (Dilithium, Imgreit, Kurilit, Sztrokayit, Protojoseit) bisher noch nicht von der International Mineralogical Association (IMA) als eigenständige Minerale anerkannt bzw. als solche diskreditiert wurden.[21] Eine Auswahl bekannter Minerale mit Tellur in verschiedenen Oxidationsstufen ist in der nachfolgenden Tabelle dargestellt.
| Telluride | Ditelluride | Gemischte Chalkogenide | Te(IV)-Minerale |
|---|---|---|---|
 Hessit Ag2Te |
 Calaverit AuTe2 (monoklin) |
 Nagyágit (Blättererz) AuPb(Pb,Sb,Bi)Te2–3S6 |
 Tellurit β-TeO2 (orthorhombisch) |
 Altait PbTe |
 Sylvanit (Schrifttellur) (Au,Ag)Te2 |
 Tetradymit Bi2Te2S |
 Zemannit Mg0,5ZnFe[TeO3]3•4,5 H2O |
Gewinnung und Darstellung
| Land | 2017 | 2018 | 2019 | 2020 | 2021 | ∅ |
|---|---|---|---|---|---|---|
| 291 | 357 | 461 | 330 | 349 | 357,6 | |
| 38 | 58 | 50 | 70 | 75 | 58,2 | |
| 44 | 46 | 50 | 55 | 56 | 50,2 | |
| 35 | 45 | 41 | 42 | 41 | 40,8 | |
| 17 | 17 | 15 | 23 | 25 | 19,4 | |
| 5 | 4 | 3 | 3 | 3 | 3,6 | |
| Summen | 430 | 527 | 620 | 523 | 549 | 529,8 |
|
Die Darstellung von Grafiken ist aktuell auf Grund eines Sicherheitsproblems deaktiviert. | ||||||
Tellur wird zusammen mit Selen industriell ausschließlich aus Nebenprodukten der großtechnischen elektrolytischen Kupfer- und Nickel-Herstellung gewonnen. In den anfallenden Anodenschlämmen sind wasserunlösliche Edelmetall-Telluride und -Selenide der allgemeinen Formel M2Ch (M = Cu, Ag, Au; Ch = Se, Te) enthalten, die bei Temperaturen oberhalb 500 °C unter Luftsauerstoff (O2) mit Soda (Natriumcarbonat Na2CO3) zur Reaktion gebracht werden. Die Edelmetall-Kationen (M+) werden dabei zu elementaren Metallen (M) reduziert, die Tellurid-Anionen zu Oxotelluraten(IV) (TeO32−) oxidiert:
Alternativ kann diese Umsetzung auch mit Salpeter (Natriumnitrat NaNO3) unter Luftausschluss und Bildung von Stickoxiden (NO und NO2) erfolgen:
Das entstandene Natriumtellurat(IV) Na2TeO3 wird anschließend in Wasser gelöst, wo es basisch reagiert und Hydrogentellurat(IV)-Ionen HTeO3− bildet. Die Abtrennung der Tellurate(IV) von den ebenfalls entstandenen Selenaten(IV) in der basischen Lösung erfolgt durch Neutralisation unter Zugabe von Schwefelsäure (H2SO4), wodurch in Wasser nahezu unlösliches Tellurdioxid TeO2 ausfällt:
Das Tellurdioxid kann entweder in Laugen durch Elektrolyse oder auf chemischem Weg durch Lösung in konzentrierten Mineralsäuren und Einleitung von Schwefeldioxid SO2 zu elementarem Tellur reduziert werden, wobei der Schwefel aus den SO2-Molekülen (bzw. den daraus in der Lösung gebildeten Sulfit-Ionen SO32−) oxidiert wird und Sulfat-Ionen (SO42−) entstehen:
Zur Gewinnung von hochreinem Tellur (> 99,9 %) wird das Zonenschmelzverfahren angewendet.
Die Weltjahresproduktion von Tellur ist von 430 Tonnen im Jahr 2017 um 28 % auf 549 Tonnen im Jahr 2021 gestiegen und lag bei durchschnittlich 529,8 Tonnen pro Jahr (t/a), wobei das Maximum bei 620 Tonnen im Jahr 2019 lag. Zu den Hauptproduzenten zählen China (∅ 357,6 t/a), Japan (∅ 58,2 t/a), Russland (∅ 50,2 t/a), Schweden (∅ 40,8 t/a), Kanada (∅ 19,4 t/a) und Bulgarien (∅ 3,6 t/a). Eine Übersicht der Produktionsmengen der einzelnen Länder ist in der Tabelle dargestellt. Weitere Industrienationen wie Deutschland und Belgien produzieren wahrscheinlich ebenfalls Tellur, es liegen jedoch keine Zahlen vor.[22] Der United States Geological Survey (USGS) schätzt die weltweit verfügbaren Reserven von Tellur im Jahr 2024 auf rund 36.000 Tonnen.[23] Tellur wird 2022 von den USA als kritischer Rohstoff eingestuft, von der EU jedoch nicht.[24][25]
Modifikationen
Kristallines Tellur
| Kristallographische Daten[26] | |
|---|---|
 Kristallines Tellur, Länge ca. 20 mm | |
| Kristallsystem | trigonal |
| Punktgruppe | 32 (Nr. 18) trigonal-trapezoedrisch |
| Raumgruppe | P3121 (Nr. 152) P3221 (Nr. 154) |
| Gitterparameter | a = 445,6(1) pm c = 592,1(2) pm |
| Formeleinheiten | Z = 3 |
| Pearson-Symbol | hP3 |



Bei Standardbedingungen ist von Tellur nur ein kristallines Allotrop (Te-I oder α-Te(llur)) bekannt, das als kristallines, metallisches oder graues Tellur bezeichnet wird. Es ist isotyp zu grauem Selen, das heißt, es hat die gleiche Kristallstruktur. Tellur kristallisiert trigonal in der Raumgruppe P3121 (Nr. 152) mit den Gitterparametern a = 445,6(1) pm und c = 592,1(2) pm (c/a = 1,33) sowie drei Formeleinheiten in der Elementarzelle.
Die nach der Hermann-Mauguin-Symbolik beschriebene Raumgruppe P3121 (Nr. 152) erläutert die Zentrierung des Gitters sowie die vorhandenen Symmetrieelemente und deren räumliche Orientierung. „P“ bedeutet, dass das Bravais-Gitter primitiv zentriert ist. Auf die Angabe der Zentrierung folgen die vorhandenen Symmetrieelemente der Raumgruppe: „31“ beschreibt eine 31-Schraubenachse (Vervielfältigung eines Teilchens durch Drehung um 120° und Parallelverschiebung (Translation) um 1⁄3 in Richtung der Drehachse) parallel zur kristallographischen c-Achse ([001]), „2“ beschreibt eine 2-zählige Drehachse (Vervielfältigung durch Drehung um 180°) parallel zu den kristallographischen a-Achsen (<100> = [100], [010]), „1“ das Symmetrieelement der 1-zähligen Drehachse oder Identität (Vervielfältigung durch Drehung um 360°, das Teilchen bildet sich also auf sich selbst ab) parallel der sechs symmetrieäquivalenten Richtungen <120> (= [120], [210], [110], [120], [210], [110]). Für die Beschreibung kristallographischer Richtungen, siehe Millersche Indizes.
Die Kristallstruktur enthält nur ein kristallographisch unterscheidbares Telluratom mit den Lagekoordinaten x = 0,2636(1), y = 0 und z = 1⁄3, das sich in spezieller Lage auf der Wyckoff-Position 3a befindet. „Spezielle Lage“ bedeutet, dass die Atomlage mit einem Symmetrieelement der Raumgruppe zusammenfällt, das Telluatom befindet sich hierbei auf der 2-zähligen Drehachse (Lagesymmetrie: .2.). Alle weiteren Telluratome in der Kristallstruktur können durch die Symmetrieelemente der Raumgruppe aus diesem Atom erzeugt bzw. auf dieses zurückgeführt werden.
| Atom | Wyckoff-Position | Lagesymmetrie | Koordinaten | ||
|---|---|---|---|---|---|
| x / a | y / b | z / c | |||
| Te | 3a | .2. | 0,2636(1) | 0 | 1⁄3 |
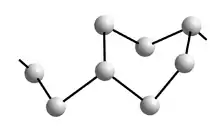
Da sich das Telluratom in seiner Lage auf der 2-zähligen Drehachse der Raumgruppe (P3121 (Nr. 152)) befindet, wird es primär durch die 31-Schraubenachse vervielfältigt. Dadurch entstehen spiralförmige Ketten aus kovalent gebundenen Telluratomen parallel zur c-Achse. Die Bindungslänge zwischen den Telluratomen innerhalb der Kette beträgt 284 pm, der Bindungswinkel liegt bei 103,1°. Die kovalenten Bindungen innerhalb der Kette sind in den Abbildungen rot hervorgehoben.
Jeweils eine Kette ist in den Abbildungen zur Verdeutlichung blau dargestellt, wobei sich das dunkelblaue Atom auf z = 1⁄3, das mittelblaue auf z = 2⁄3 und das hellblaue auf z = 1 beziehungsweise z = 0 befindet. Jedes dritte Atom innerhalb der Kette ist also deckungsgleich.
Jede Kette wird von sechs weiteren Ketten umgeben. Zwischen den Ketten existieren Van-der-Waals-Bindungen mit Te–Te-Abständen von 349 pm (grün gestrichelt), die durch die Unterschreitung des Van-der-Waals-Radius (2 · 206 pm = 412 pm) der Telluratome zustande kommen. Für ein einzelnes Telluratom ergibt sich dabei eine Koordinationszahl von 6, genauer 2+4, da 2 Atome aus der gleichen Kette stammen und damit einen geringeren Abstand als die weiteren 4 aus den Nachbarketten aufweisen. Als Koordinationspolyeder ergibt sich damit jeweils ein verzerrtes Oktaeder (gelb hervorgehoben).
Tellur kann auch in der Raumgruppe P3221 (Nr. 154) anstatt P3121 (Nr. 152) mit denselben Gitterparametern kristallisieren. Die 32-Schraubenachse vervielfältigt ein Atom ebenfalls durch Drehung um 120°, anschließend wird es jedoch um 2⁄3 (anstatt 1⁄3) in Richtung der Drehachse verschoben. Dadurch entstehen ebenfalls spiralförmige Ketten, die sich jedoch im Uhrzeigersinn statt im Gegenuhrzeigersinn (bei der 31-Schraubenachse) entlang der c-Achse winden. Die Kristallstruktur in der Raumgruppe P3221 (Nr. 154) („Linksform“) ist somit das Spiegelbild der Struktur in der Raumgruppe P3121 (Nr. 152) („Rechtsform“). Das Auftreten von spiegelbildlichen Kristallformen wird in der Kristallographie als Enantiomorphie bezeichnet.
Das Kristallsystem von Tellur wird – vor allem in englischsprachiger Literatur – zum Teil auch als hexagonal angegeben. Dem hexagonalen und trigonalen Kristallsystem liegt dasselbe Gittersystem zugrunde, da beide der hexagonalen Kristallfamilie angehören. Eine hexagonale Symmetrie würde jedoch zwingend das Vorhandensein eines Symmetrieelements mit Drehung um 60° – d. h. eine 6-zählige Dreh- (6), Drehinversions- (6) oder Schraubenachse (6n) – voraussetzen. Die Kristallstruktur von Tellur beinhaltet jedoch nur eine 31- oder 32-Schraubenachse mit jeweils Drehung um 120° und gehört damit zweifelsfrei in das niedriger symmetrische trigonale Kristallsystem.
Hochdruck-Modifikationen des Tellurs
In Hochdruckexperimenten mit kristallinem Tellur (Te-I oder α-Tellur) konnten weitere Modifikationen beschrieben werden. Die Angaben zu den Druckbereichen für die Stabilität sowie die Raumgruppen der Hochdruck-Modifikationen variieren zum Teil in der Literatur:
- Te-II kristallisiert monoklin im Druckbereich von 4 bis 6,6 GPa. Als mögliche Raumgruppen werden in der Literatur P21 (Nr. 4) oder C2/m (Nr. 12) genannt.
- Te-III soll orthorhombisch kristallisieren und im Druckbereich oberhalb 6,6 GPa stabil sein. Für diese Modifikation existiert jedoch nur eine theoretische Berechnung in der Raumgruppe Imma (Nr. 74).
- Te-IV kristallisiert trigonal in der Raumgruppe R3m (Nr. 166) und entspricht der β-Struktur des höheren Homologen Polonium. Es ist im Druckbereich von 10,6 bis 27 GPa stabil. Die Abstände der Telluratome innerhalb der Ketten und zu benachbarten Ketten sind in dieser Modifikation gleich und betragen jeweils 300 pm, wodurch sich die höhere Symmetrie im Vergleich zu Te-I erklärt.
- Te-V soll oberhalb von 27 GPa stabil sein. Für diese Modifikation wird ein kubisch-raumzentriertes Gitter (Raumgruppe Im3m (Nr. 229)) angenommen.
Amorphes Tellur
Die unbeständige amorphe Modifikation ist ein braunes Pulver und kann aus Telluriger Säure (H2TeO3) durch Reaktion mit Schwefliger Säure (H2SO3) beziehungsweise Sulfit-Ionen (SO32−) dargestellt werden. Die Sulfit-Ionen werden dabei zu Sulfat-Ionen (SO42−) oxidiert während die Te4+-Kationen zu elementarem Tellur reduziert werden:
Amorphes Tellur wandelt sich unter Standardbedingungen langsam in die thermodynamisch stabile – oben beschriebene – kristalline Modifikation Te-I um.
Eigenschaften
Physikalische Eigenschaften
Kristallines Tellur ist ein intrinsischer direkter Halbleiter mit einer Bandlücke von 0,334 eV. Die elektrische Leitfähigkeit lässt sich wie bei allen Halbleitern durch Temperaturerhöhung oder Belichtung steigern, dies führt bei Tellur jedoch nur zu einem geringen Anstieg. Die elektrische Leitfähigkeit und Wärmeleitfähigkeit verhält sich bei Tellur richtungsabhängig, das heißt anisotrop. Kristallines Tellur ist ein weiches (Mohshärte 2,25) und sprödes Material, das sich leicht zu Pulver verarbeiten lässt. Durch Druckerhöhung wandelt sich Tellur in weitere kristalline Modifikationen um. Oberhalb von 450 °C geht Tellur in eine rote Schmelze über, bei Temperaturen über 990 °C liegt Tellur als gelbes diamagnetisches Gas aus Te2-Molekülen vor. Bei Temperaturen über 2000 °C zerfallen die Te2-Moleküle in einzelne Atome.
Chemische Eigenschaften
Kristallines Tellur ist unlöslich in Wasser und schlecht löslich in den Mineralsäuren Salzsäure und Schwefelsäure sowie in Laugen. Gut löslich ist es hingegen in Salpetersäure, da diese ein sehr starkes Oxidationsmittel ist und elementares Tellur zu Telluraten mit der stabilen Oxidationsstufe +IV oxidiert. Tellurschmelzen greifen Kupfer, Eisen und rostfreien Edelstahl an.
In Verbindungen mit Nichtmetallen verhält sich Tellur wie das leichtere Gruppenmitglied Selen. An Luft verbrennt es in einer grün gesäumten, blauen Flamme zu Tellurdioxid TeO2:
Tellur reagiert spontan mit Halogenen unter Bildung von Tellurhalogeniden. Bemerkenswert ist hierbei, dass Tellur im Gegensatz zu den leichteren Homologen Selen und Schwefel auch thermodynamisch stabile Iodide bildet, darunter Telluriodid TeI mit der Oxidationsstufe +I. Mit unedlen Metallen wie zum Beispiel Zink reagiert es heftig zu den entsprechenden Telluriden.
Isotope
Von Tellur sind Isotope mit Massenzahlen zwischen 105 und 142 bekannt.[28] Natürliches Tellur ist ein Mischelement, das aus acht Isotopen besteht, von denen fünf (122Te, 123Te, 124Te, 125Te, 126Te) stabil sind. Das Isotop 123Te sollte theoretisch unter Elektroneneinfang zu 123Sb zerfallen. Dieser Zerfall wurde jedoch noch nicht beobachtet; die untere Grenze für seine Halbwertszeit beträgt 9,2 · 1016 Jahre (92 Billiarden Jahre). Das Isotop 120Te geht über den doppelten Elektroneneinfang direkt in 120Sn über. Die Isotope 128Te und 130Te wandeln sich durch Emission von Betastrahlung (Doppelter Betazerfall) in 128Xe beziehungsweise 130Xe um.
Den größten Anteil an natürlichem Tellur bildet zu ungefähr einem Drittel das Isotop 130Te mit einer Halbwertszeit von 7,9 · 1020 Jahren, gefolgt vom Isotop 128Te. Die durchschnittliche Atommasse der natürlichen Tellur-Isotope beträgt daher 127,60 und ist damit größer als die des im Periodensystem folgenden Reinelements Iod mit 126,90. 128Te gilt als das Isotop mit dem langsamsten Zerfall aller nichtstabilen Isotope sämtlicher Elemente. Der äußerst langsame Zerfall mit einer Halbwertszeit von 7,2 · 1024 Jahren (7 Quadrillionen Jahren, d. h. in 1 Kilogramm zerfällt alle 18 Monate ein Atom)[29] konnte nur aufgrund der Detektion des Zerfallsproduktes (128Xe) in sehr alten Proben natürlichen Tellurs festgestellt werden.[30]
Von den übrigen Isotopen hat das Kernisomer 121mTe mit 154 Tagen die längste Halbwertzeit. Auch bei den Isotopen 127Te und 129Te liegen die Halbwertszeiten der Isomere über denen des Grundzustands. Als Tracer wird am häufigsten das Isotop 127Te verwendet, gefolgt von 121Te. Die Isotope 127Te und 129Te treten auch als Spaltprodukte bei der Kernspaltung in Atomreaktoren auf.
→ Siehe auch: Liste der Tellur-Isotope
Verwendung

Tellur ist ein technisch weniger bedeutendes Element, da es teuer in der Herstellung ist und in der Verwendung häufig andere Elemente beziehungsweise Verbindungen gleichwertig sind. 2016 wurde für elementares, polykristallines und dotiertes Tellur thermoelektrisches Verhalten mit einer hohen Gütezahl im Bereich zwischen Raumtemperatur und 400 °C nachgewiesen.[31] Elementares Tellur wird in der Metallindustrie unter anderem als Zusatz (< 1 %) für Stahl, Gusseisen, Kupfer- und Blei-Legierungen sowie in rostfreien Edelstählen verwendet. Es fördert die Korrosionsbeständigkeit und verbessert die mechanischen Eigenschaften sowie die Bearbeitbarkeit. Als Halbleiter wird reines Tellur bisher nur wenig eingesetzt, meist wird Tellur in II-VI-Verbindungshalbleitern verwendet. Cadmiumtellurid CdTe wird z. B. in Fotodioden und Dünnschicht-Solarzellen zur Stromerzeugung aus Licht verwendet.
Bismuttellurid Bi2Te3 wird in Thermoelementen zur Stromerzeugung in thermoelektrischen Generatoren (z. B. in Radionuklidbatterien) bzw. in Peltier-Elementen zur Kühlung eingesetzt.
Kombinationen aus Germanium- (GeTe) und Antimon-Telluriden (Sb2Te3) werden in Phasenwechselmaterialien als Bestandteil optischer Speicherplatten (z. B. CD-RW) oder in neuartigen Speichermaterialien wie Phase Change Random Access Memory verwendet.
Gläser aus Tellurdioxid TeO2 werden aufgrund der hohen Brechungsindices anstelle von Kieselglas SiO2 in Lichtwellenleitern eingesetzt.
In der Mikrobiologie wird mit farblosem Kaliumtellurat(IV) K2TeO3 versetzter Agar als selektives Nährmedium zum Nachweis von Staphylokokken und Corynebacterium diphtheriae benutzt. Die Bakterienkolonien erscheinen dabei als kleine schwarze Kugeln, da sie die Te4+-Kationen zu elementarem Tellur reduzieren und in ihre Zellen einlagern.
Medizinische Verwendung fand Tellur (bzw. Kaliumtellurat) erstmals 1890 zur Behandlung von nächtlichen Schweißausbrüchen bei an Tuberkulose erkrankten Patienten.[32]
Weiterhin werden geringe Mengen von Tellur zur Vulkanisierung von Gummi, in Sprengkapseln und zum Färben von Glas und Keramik verwendet. Die Salze des Tellurs werden teilweise zur Erzeugung einer grasgrünen Farbgebung bei Feuerwerken verwendet.[33]
Sicherheitshinweise und Toxizität
Tellur ist in löslicher Form ein für den menschlichen Organismus giftiges Element und wurde daher in der Vergangenheit als giftig eingestuft. Da elementares Tellur jedoch sehr schlecht in Wasser und körpereigenen Säuren löslich ist, wurde es auf gesundheitsschädlich herabgestuft. Studien der Niederländischen Organisation für Angewandte Naturwissenschaftliche Forschung (TNO) zeigten, dass der LD50 (oral)-Wert für Ratten bei > 5000 mg/kg liegt. Der in vielen Sicherheitsdatenblättern angegebene Wert von 83 mg/kg aus dem Buch Toxicometric Parameters of Industrial Toxic Chemicals under single Exposure von N.F. Ismerow, der aus dem Jahr 1982 stammt,[34] gilt nur für leichtlösliche Tellurverbindungen. Trotzdem verwenden verschiedene Hersteller für elementares Tellur (Pulver) weiterhin den alten LD50-Wert und die Einstufung giftig in Verbindung mit dem H-Satz 301 („Giftig beim Verschlucken“).[35]
Tellur ist nicht so giftig wie Selen. Dies steht in Analogie zu den benachbarten Elementen der 5. Hauptgruppe, wo das Antimon ebenfalls weniger giftig als das Arsen ist. Gelangt Tellur vor allem in Form von leichtlöslichen Tellurverbindungen wie Alkalimetall-Tellurate (zum Beispiel Na2TeO3) durch Verschlucken (peroral) in den Körper, bildet sich durch Reduktion giftiges Dimethyltellurid (Me2Te: H3C–Te–CH3), das zur Schädigung von Blut, Leber, Herz und Nieren führen kann. Da leichtlösliche Tellurverbindungen dabei weit mehr Tellur freisetzen, werden diese auch als gefährlicher eingestuft. Tellurvergiftungen machen sich durch einen intensiven, zuerst 1824 von Christian Gottlob Gmelin (bei seinen erstmals vorgenommenen Untersuchungen der Wirkung von Tellur auf Lebewesen)[36] beschriebenen Knoblauchgeruch der Atemluft bemerkbar, der durch das Dimethyltellurid hervorgerufen wird. Dieser entfernt sich erst nach mehreren Wochen und entfaltet sich selbst bei sehr geringen Mengen, die noch keine schwerwiegenden Vergiftungen hervorrufen. Dieser Knoblauchgeruch kann, im Gegensatz zu echtem Knoblauch, nicht durch Zähneputzen entfernt werden. Auch setzt dieser sich in einem Raum fest und entfernt sich erst nach mehreren Stunden.[37] Es wird ebenfalls über die Haut langsam ausgeschieden.
Tellurstäube können sich in Luft selbst entzünden und fein verteilt in entsprechender Konzentration auch explosiv reagieren, wobei sich jeweils Tellurdioxid TeO2 bildet. Wie andere Metallstäube kann Tellurpulver auch mit Interhalogenverbindungen wie Brompentafluorid BrF5 explosiv reagieren. Eine Maximale Arbeitsplatz-Konzentration (MAK) für Tellur ist nicht festgelegt.[13][38]
Nachweis
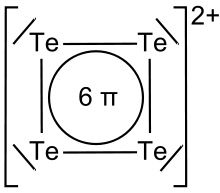

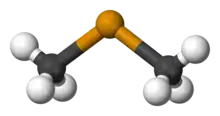
Elementares Tellur kann in heißer konzentrierter Schwefelsäure (H2SO4) durch Oxidation des Tellurs unter Bildung des roten Te42+-Kations (Tetratellur-Dikation) nachgewiesen werden. Ein Teil der Schwefelsäure wird bei der Reaktion zu Schwefliger Säure (H2SO3) reduziert, die aufgrund der hohen Temperaturen in Wasser (H2O) und ihr Anhydrid Schwefeldioxid (SO2) zerfällt, welches als Gas entweicht:
Die Farbe des quadratisch-planar aufgebauten Te42+-Kations kommt durch sechs delokalisierte π-Elektronen zustande, die einen Teil des sichtbaren Lichts absorbieren. Die übrigen, nicht absorbierten Wellenlängen des Lichts ergeben die Komplementärfarbe Rot.
Tellurat und Tellurit können mittels Polarographie speziiert, d. h. selektiv nebeneinander bestimmt werden.[39] Während die Stufe des Tellurats bei −1,66 V liegt, erscheint diejenige des Tellurits bei −1,22 V (gegen SCE, 0,1 M Natronlauge). Beide Tellurspezies werden dabei in einem Schritt zum Tellurid reduziert. Spuren von 0,03 % Tellurat bzw. 0,003 % Tellurit sind auf diese Weise erfassbar. Wesentlich nachweisstärker sind die Methoden der Atomspektroskopie. Während man mit der Flammen-AAS eine Nachweisgrenze von 20 µg/l erreicht, liegt dieser Wert bei der Graphitrohr-AAS (0,2 µg/l) sowie der Hydridtechnik (0,02 µg/l) noch wesentlich niedriger.[40]
Tellurverbindungen
In Verbindungen tritt Tellur am häufigsten in den Oxidationsstufen −II (Telluride) und +IV (Tetrahalogenide, Tellurdioxid und Tellurate(IV), veraltet Tellurite) auf. Seltener sind die Oxidationsstufen +VI (Tellurate(VI)) und +II (Dihalogenide) sowie −I (Ditelluride) und +I (Monohalogenide, nur bekannt als TeI).
Wasserstoffverbindungen
Tellurwasserstoff H2Te ist ein farbloses, sehr giftiges Gas, das durch Reaktion von Telluriden (MxTey) mit starken Säuren, zum Beispiel Salzsäure HCl, entsteht. Aus den Elementen (Wasserstoff und Tellur) ist die Verbindung als stark endotherme Verbindung nur bei Temperaturen über 650 °C darstellbar. In Wasser gelöst (Tellurwasserstoffsäure) reagiert es sauer, wobei die Säurestärke in etwa der Phosphorsäure entspricht. An der Luft zersetzt sich die wässrige Lösung umgehend zu Wasser und elementarem Tellur.
Sauerstoffverbindungen
Tellurdioxid (Tellur(IV)-oxid) TeO2 ist ein farbloser kristalliner Feststoff und das wichtigste Oxid des Tellurs. Es entsteht bei der Verbrennung von elementarem Tellur an Luft. Es ist das Anhydrid der schwach amphoteren und unbeständigen Tellurigen Säure H2TeO3. Tellurdioxid existiert in einer orthorhombischen (Tellurit, Raumgruppe: Pbca) und einer tetragonalen (Paratellurit, Raumgruppe: P43212) Modifikation, die in der Natur auch als Minerale auftreten.
Tellurtrioxid (Tellur(VI)-oxid) TeO3 ist ein gelber, trigonal/rhomboedrisch kristallisierender Feststoff und das Anhydrid der Orthotellursäure H6TeO6. Es entsteht bei der Entwässerung der Orthotellursäure durch starke Temperaturerhöhung. Die gelbe Farbe kommt durch Elektronenübertrag des Sauerstoffs auf das Tellur („Charge-Transfer“) zustande.
Tellurmonoxid (Tellur(II)-oxid) TeO ist ein weiteres, bei Standardbedingungen jedoch instabiles Oxid des Tellurs. Es wird als schwarzer amorpher Feststoff beschrieben und reagiert in feuchter Luft mit Sauerstoff zum stabileren Tellurdioxid TeO2.
Ditellurpentoxid (Tellur(IV)-Tellur(VI)-oxid) ist ein gemischtes Telluroxid mit Te4+- und Te6+-Kationen. Es ist neben Tellurtrioxid ein weiteres Produkt bei der thermischen Zersetzung der Orthotellursäure und kristallisiert im monoklinen Kristallsystem.
Tellurate sind die Salze der Orthotellursäure H6TeO6 und Metatellursäure H2TeO4 mit den Anionen [TeO6]6− beziehungsweise [TeO4]2−. Die Salze der Tellurigen Säure H2TeO3 mit dem Anion [TeO3]2− werden als Tellurate(IV) (veraltet Tellurite) bezeichnet.
Halogenverbindungen
Tetrahalogenide TeX4 mit Tellur in der Oxidationsstufe +IV sind die häufigsten Tellur-Halogenide. Diese sind mit allen Halogenen (Fluor, Chlor, Brom und Iod) bekannt. Bei allen Verbindungen handelt es sich um kristalline Feststoffe.
Dihalogenide TeX2 mit Tellur in der Oxidationsstufe +II sind nur mit Chlor, Brom und Iod bekannt, sie existieren nur in der Gasphase.
Monohalogenide TeX existieren von Tellur nur mit Iod als Telluriodid TeI. Es ist das einzig bekannte thermodynamisch stabile Mono-Iodid der Chalkogene und ein dunkler kristalliner Feststoff. Tellur hat in dieser Verbindung die ungewöhnliche Oxidationsstufe +I.
Subhalogenide enthalten Te mit einer Oxidationsstufe, die kleiner als +I ist. Stabile Vertreter sind Te2I, Te2Br und Te3Cl2.
Hexahalogenide TeX6 mit Tellur in der Oxidationsstufe +VI sind nur als Tellurhexafluorid TeF6 oder Tellurpentafluoridchlorid TeF5Cl bekannt. Beides sind farblose Gase. Tellurhexafluorid ist das reaktivste Chalkogenhexafluorid (neben Schwefelhexafluorid SF6 und Selenhexafluorid SeF6) und wird als einziges in Wasser hydrolysiert.
Weiterhin existieren von Tellur in der Oxidationsstufe +IV in wässriger Lösung auch Komplexverbindungen [TeX6]2− (X = F−, Cl−, Br−, I−) mit allen Halogenid-Ionen. Mit Ausnahme des Hexafluoro-Komplexes sind alle anderen perfekt oktaedrisch aufgebaut und können auch als Salze aus der Lösung gefällt werden (zum Beispiel gelbes Ammonium-hexachloridotellurat(IV) (NH4)2[TeCl6], rotbraunes Ammonium-hexabromidotellurat(IV) (NH4)2[TeBr6] oder schwarzes Cäsium-hexaiodidotellurat(IV) Cs2[TeI6]).
Organotellur-Verbindungen
Tellur bildet eine Reihe von metallorganischen Verbindungen. Diese sind aber sehr instabil und werden in der organischen Synthese wenig verwendet. Als reine Tellurorganyle sind Verbindungen der Form R2Te, R2Te2, R4Te und R6Te (R jeweils Alkyl-, Aryl-) bekannt.[41]
Daneben sind noch Diorganotellurdihalogenide R2TeX2 (R = Alkyl-, Aryl-; X = F, Cl, Br, I) und Triorganotellurhalogenide R3TeX (R = Alkyl-, Aryl-; X = F, Cl, Br, I) bekannt.
Tellurpolykationen

Durch vorsichtige Oxidation von Tellur können neben dem schon erwähnten Te42+ zahlreiche Tellurpolykationen Tenx+ dargestellt und mit einem geeigneten Gegenion kristallisiert werden.[42] Das Gegenion muss eine schwache Lewis-Base sein, da die Tellurpolykationen verhältnismäßig starke Lewissäuren sind. Geeignete Oxidationsmittel sind häufig Halogenide der Übergangsmetalle, die bei Temperaturen von typischerweise 200 °C direkt die gewünschte Verbindung ergeben:
Häufig ist die Kristallisation unter den Bedingungen des chemischen Transports erfolgreich, bisweilen müssen aber wasserfreie Lösungsmittel wie Zinn(IV)-chlorid oder Siliciumtetrabromid verwendet werden. Auch Salzschmelzen stellen in Einzelfällen geeignete Reaktionsmedien dar. Ist das Metallhalogenid kein geeignetes Oxidationsmittel, wie das bei Halogeniden der Hauptgruppenelemente in der Regel der Fall ist, können die entsprechenden Tellurtetrahalogenide als Oxidationsmittel verwendet werden:
Durch Variation des Gegenions und des Reaktionsmediums konnte eine große Vielfalt von Polykationen dargestellt werden; auch gemischte Selen-Tellurpolykationen sind durch entsprechende Wahl der Reaktanten der Synthese zugänglich. Neben den gezeigten ketten- bzw. bandförmigen Polykationen gibt es auch isolierte Polykationen wie Te62+, Te64+ und Te84+.
Literatur
- Allgemeines und Verbindungen
- Frank Hoffmann: Faszination Kristalle und Symmetrie – Einführung in die Kristallographie. 1. Auflage. Springer Spektrum, Berlin 2016, ISBN 978-3-658-09581-9, S. 173–174.
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 692–728 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eberhard Schweda (Hrsg.): Jander/Blasius – Anorganische Chemie I. 19. Auflage. Hirzel, Stuttgart 2021, ISBN 978-3-7776-3009-0, S. 261–262.
- Entdeckung und Geschichte
- E. Diemann, A. Müller, H. Barbu: Die spannende Entdeckungsgeschichte des Tellurs (1782–1798) – Bedeutung und Komplexität von Elemententdeckungen. In: Chemie in unserer Zeit. Band 36, Nr. 5, 2002, S. 334–337, doi:10.1002/1521-3781(200210)36:5<334::AID-CIUZ334>3.0.CO;2-1.
- Tomas Kron, Eckehard Werner: Kurze Geschichte des Elements Tellur in Biologie und Medizin. In: Würzburger medizinhistorische Mitteilungen. 8, 1990, S. 279–288.
- Sonderheft zum 250. Geburtstag von Franz Joseph Müller von Reichenstein und der Entdeckung des Elements Tellur. In: Montanhistorischer Verein für Österreich (Hrsg.): res montanarum. Band 5, 1992.
Weblinks
Einzelnachweise
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Tellur) entnommen.
- CIAAW, Standard Atomic Weights Revised 2013.
- Eintrag zu tellurium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- Eintrag zu tellurium bei WebElements, www.webelements.com, abgerufen am 11. Juni 2020.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Tellur) entnommen.
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Tellur) entnommen.
- Allen J. Bard, Roger Parsons, Joseph Jordan: Standard Potentials in Aqueous Solution. Marcel Dekker, New York 1985, ISBN 0-8247-7291-1.
- R. K. Harris, E. D. Becker, S. M. Cabral de Menezes, R. Goodfellow, P. Granger: NMR Nomenclature. Nuclear spin properties and conventions for chemical shifts (IUPAC Recommendations 2001). In: Pure Applied Chemistry. Band 73, Nr. 11, 2001, S. 1795–1818. (PDF; 325 kB).
- Eintrag zu Tellur im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 3. August 2023. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Tellur in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- I. von Born: Nachricht vom gediegenen Spiesglaskönig in Siebenbürgen. In: Abhandlungen einer Privatgesellschaft in Böhmen. Band 5, 1782, S. 382–386.
- F. J. von Müller Reichenstein: Schreiben an Herrn Hofrath von Born. Über den vermeintlichen natürlichen Spiesglanzkönig. In: Physikalische Arbeiten der einträchtigen Freunde in Wien. 1. Quartal, 1783, S. 57–59.
- F. J. von Müller Reichenstein: Versuche mit dem in der Grube Mariahilf in dem Gebirge Fazeby bey Zalathna vorkommenden vermeinten gediegenen Spiesglanzkönig. In: Physikalische Arbeiten der einträchtigen Freunde in Wien. 1. Quartal, 1783, S. 63–69;
Fortsetzung der Versuche mit dem in der Grube Mariahilf in dem Gebirge Fazeby bey Zalathna vorkommenden vermeinten gediegenen Spiesglanzkönig. In: Physikalische Arbeiten der einträchtigen Freunde in Wien. 2. Quartal, 1784, S. 49–53;
Nachricht von den Golderzen aus Nagyag in Siebenbürgen. In: Physikalische Arbeiten der einträchtigen Freunde in Wien. 2. Quartal, 1784, S. 85–87;
Fortsetzung der Versuche mit dem in der Grube Mariahilf in dem Gebirge Fazeby bey Zalathna vorkommenden vermeinten gediegenen Spiesglanzkönig. In: Physikalische Arbeiten der einträchtigen Freunde in Wien. 3. Quartal, 1785, S. 344–352. - M. H. Klaproth: Chemische Untersuchung der Siebenbürgischen Golderze. In: Sammlung der deutschen Abhandlungen, welche in der Königlichen Akademie der Wissenschaften zu Berlin vorgelesen worden in den Jahren 1789–1800. 1803, S. 15.
- A. J. Bradley: The crystal structures of the rhombohedral forms of selenium and tellurium. In: Philosophical Magazine. Band 48, Nr. 285, 1924, S. 477–496, doi:10.1080/14786442408634511.
- S. A. Williams, R. V. Gaines: Carlfriesite, H4Ca(TeO3)3, a new mineral from Moctezuma, Sonora, Mexico. In: Mineralogical Magazine. Nr. 40, 1975, S. 127–130.
- H. Effenberger, J. Zemann, H. Mayer: Carlfriesite: crystal structure, revision of chemical formula, and synthesis. In: American Mineralogist. Nr. 63, 1978, S. 847–852.
- Webmineral – Mineral Species containing the element Te (Tellurium).
- World Mineral Production 2017–2021. (PDF; 1,0 MB) BGS, April 2023, S. 70, abgerufen am 14. April 2023 (englisch).
- Mineral Commodity Summaries 2024. (PDF; 13,9 MB) USGS, 31. Januar 2024, S. 178–179, abgerufen am 26. Februar 2024 (englisch).
- Europäische Kommission Critical Raw Materials.
- Federal Register der US-Bundesregierung, 2022 final list of critical materials.
- Claire Adenis, Vratislav Langer, Oliver Lindquist: Reinvestigation of the Structure of Tellurium. In: Acta Crystallographica. Section C, Nr. 45, 1989, S. 941–942, doi:10.1107/S0108270188014453.
- Mois I. Aroyo (Hrsg.): International Tables for Crystallography. 6. Auflage. Volume A: Space-group symmetry. Wiley, New York 2016, ISBN 978-0-470-97423-0, S. 511.
- G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics. Band A 729, 2003, S. 3–128. doi:10.1016/j.nuclphysa.2003.11.001. (PDF; 1,0 MB).
- Karlsruher Nuklidkarte. korrigierte 6. Auflage. 1998.
- Laboratory for Space Science: Noble Gas Research (Memento vom 28. September 2011 im Internet Archive).
- S. Lin u. a.: Tellurium as a high-performance elemental thermoelectric. In: Nature Communications. 7, 2016, 10287, doi:10.1038/ncomms10287.
- Edmund Neusser: Ueber tellursaures Kalium als Mittel gegen die Nachtschweisse der Phthisiker. In: Wiener klinische Wochenschrift. 3, 1890, S. 437–438.
- Markus Miller: Der große Strategie- und Edelmetall-Guide: Das FORT KNOX für Privatanleger. FinanzBuch Verlag, 2012, ISBN 978-3-86248-266-5, S. 95 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Tellurium in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 6. Dezember 2015. (Seite nicht mehr abrufbar)
- gr.nl: Tellurium and tellurium compounds No. 2000/15OSH/055, The Hague, 31. Oktober 2002, abgerufen am 6. Dezember 2015.
- Christian Gottlob Gmelin: Versuche über die Wirkungen des Baryts, Strontians, Chroms, Molybdäns, Wolframs, Tellurs, Titans, Osmiums, Platins, Iridiums, Rhodiums, Palladiums, Nickels, Kobalts, Urans, Ceriums, Eisens und Mangans auf den thierischen Organismus. Tübingen 1824, S. 43.
- Sam Kean: Die Ordnung der Dinge – im Reich der Elemente. Hoffmann und Campe, 2011, ISBN 978-3-455-50208-4, S. 445.
- MAK-Dokumentation für Tellur, doi:10.1002/3527600418.mb1349480verd0037 (freier Volltext)
- J. Heyrovský, J. Kůta: Grundlagen der Polarographie. Akademie-Verlag, Berlin 1965, S. 517.
- K. Cammann (Hrsg.): Instrumentelle Analytische Chemie. Spektrum Akademischer Verlag, Heidelberg/ Berlin, 2001, S. 4–47.
- Ch. Elschenbroich: Organometallchemie. 5. Auflage. Teubner, 2005.
- J. Beck: Rings, cages and chains – The rich structural chemistry of the polycations of the chalcogens. In: Coordination Chemistry Reviews. 163, 1997, S. 55–70, doi:10.1016/S0010-8545(97)00009-X


