Sulfone
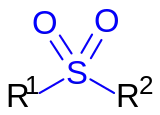
Sulfone (sg: Sulfon) sind eine Klasse von Verbindungen mit organisch gebundenem Schwefel und Sauerstoff mit der allgemeinen Strukturformel R1-S(=O)2-R2, dabei sind R1 und R2 organische Reste. Die Einzahl Sulfon wird häufig auch als Trivialname für das Dimethylsulfon verwendet (R1 = R2 = CH3). Dimethylsulfon ist ein Beispiel für ein symmetrisches Sulfon (R1 = R2). Bei unsymmetrischen Sulfonen gilt: R1 ≠ R2. In der Natur besitzen Sulfone nur eine untergeordnete Bedeutung.[1]
Darstellung
Sulfone lassen sich industriell und im Labor durch Oxidation von Thioethern, z. B. mit Wasserstoffperoxid, Kaliumpermanganat oder anderen Oxidationsmitteln gewinnen. Die entsprechenden Sulfoxide sind dabei Zwischenprodukte.[2]
Eigenschaften
Sulfone sind schwer flüchtige und polare Verbindungen, sie sind bei Raumtemperatur meist Feststoffe. Sulfone sind chemisch recht beständig und lassen sich nur schwer oxidieren und recht schwer reduzieren. Wasserstoffe am α-ständigen Kohlenstoff sind durch den −M-Effekt der Sulfongruppe acide.
Verwendungen
Einige Sulfone sind als Medikamente in Gebrauch, z. B. der Arzneistoff Dapson (4,4'-Diaminodiphenylsulfon) oder Sulfonal.
Einzelnachweise
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich, 2006, S. 235, ISBN 978-3-906390-29-1.
- Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 479–480, ISBN 3-342-00280-8.