Succinyl-CoA-Synthetasen
Succinyl-CoA-Synthetasen (SCS) (auch: Succinat-CoA-Ligasen) sind Enzymkomplexe des Citratzyklus in allen Lebewesen. Die SCS katalysieren ein Reaktionsgleichgewicht zwischen Succinat und Coenzym A einerseits und Succinyl-CoA unter Verbrauch/Gewinn des energiereichen GTP (EC 6.2.1.4) oder ATP (EC 6.2.1.5) andererseits.
Die vereinfachte Reaktionsgleichung dieses Gleichgewichts lautet[1]:
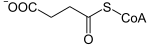 + ADP/GDP + Pi
+ ADP/GDP + Pi  + ATP/GTP + CoA-SH
+ ATP/GTP + CoA-SH
Die Energie der Spaltung des Succinyl-CoA wird zur Bildung von GTP/ATP genutzt. Im Citratzyklus verläuft die Reaktion von links nach rechts und ein Molekül ATP/GTP wird gewonnen. Beim reduktiven Citratzyklus findet in manchen Bakterien die Rückreaktion statt (dann werden die SCS als Succinat-Thiokinasen bezeichnet).
Die GDP-bildenden SCS kommen in allen Lebewesen (bei Eukaryoten in den Mitochondrien) vor, während die ADP-bildenden bei Eukaryoten zusätzlich im Zytosol gefunden werden. In Bakterien bilden die SCS Heterotetramere. Beim Menschen ist ein GDP- und ein ADP-bildendes Isozym-Dimer (Gen-Namen SUCLG1/2 sowie SUCLG1/A2) bekannt. Mutationen im menschlichen SUCLG1-Gen können (seltenen) Enzymmangel im Embryo und dieser infantile Laktatazidose verursachen, die fatal verläuft. Defekte in SUCLA2 können zu einer sehr seltenen mitochondriellen Stoffwechselstörung mit Organschäden führen. In beiden Fällen ist Methylmalonsäure im Urin feststellbar.[2][3][4][5]
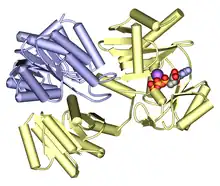
Struktur
Bakterien- und Säugetier-SCS bestehen aus α- und β-Untereinheiten.[6] In E. coli verbinden sich zwei αβ-Heterodimere miteinander, um eine heterotetramere α2β2-Struktur zu bilden. Mitochondriale SCS von Säugetieren sind jedoch als αβ-Dimere aktiv und bilden kein Heterotetramer.[7]
Einzelnachweise
- J. M. Berg, J. L. Tymoczko, L. Stryer: Stryer Biochemie. 7. Auflage. Springer, Berlin 2013, ISBN 978-3-8274-2988-9, S. 515.
- UniProt P53597
- Orphanet: Laktazidose, infantile kongenitale
- Orphanet: Mitochondriales DNA-Depletionssyndrom
- D. O. Lambeth, K. N. Tews u. a.: Expression of two succinyl-CoA synthetases with different nucleotide specificities in mammalian tissues. In: The Journal of biological chemistry. Band 279, Nummer 35, August 2004, S. 36621–36624. doi:10.1074/jbc.M406884200. PMID 15234968.
- J. S. Nishimura: Succinyl-CoA synthetase structure-function relationships and other considerations. In: Advances in enzymology and related areas of molecular biology. Band 58, 1986, S. 141–172, doi:10.1002/9780470123041.ch4, PMID 3521216 (Review).
- W. T. Wolodko, C. M. Kay, W. A. Bridger: Active enzyme sedimentation, sedimentation velocity, and sedimentation equilibrium studies of succinyl-CoA synthetases of porcine heart and Escherichia coli. In: Biochemistry. Band 25, Nummer 19, September 1986, S. 5420–5425, doi:10.1021/bi00367a012, PMID 3535876.
Weblinks
- Proteopedia: Succinyl-CoA_Synthetase