Stickoxide
Stickoxide oder Stickstoffoxide[1] ist ein Sammelbegriff für zahlreiche gasförmige Oxide des Stickstoffs. Stickstoffmonoxid (NO) und Stickstoffdioxid (NO2) werden als NOx zusammengefasst. In NOx-Gemischen höherer Konzentration kommen auch die Spezies N2O3 und N2O4 vor. Diese Gemische werden als nitrose Gase bezeichnet,[2] vor allem im Bereich Arbeitsschutz. In der Luftchemie werden NOx und andere Stickoxide mit einer Oxidationsstufe von 2 oder mehr, darunter auch Säuren und organische Spezies, mit dem Symbol NOy zusammengefasst.[3]
Bildung und Eigenschaften
Die Stickstoffoxide bilden sich aus den Elementen ausnahmslos durch endotherme Reaktionen, das heißt, sie bilden sich aus den Elementen nur unter äußerem Zwang (Energiezufuhr). Dies bedingt andererseits ihre technische Verwendbarkeit als Oxidationsmittel, zum Beispiel Distickstofftetroxid in der Raketentechnik, oder Lachgas (Distickstoffmonoxid, N2O) für heiße Flammen. Mit Ausnahme des Lachgases verhalten sie sich gegenüber Wasser (beispielsweise in der Erdatmosphäre) als Säurebildner. Unter anderem wegen dieser Säurebildung (auf den Schleimhäuten) wirken sie reizend und giftig. Damit zogen sie (mit Ausnahme des Lachgases) schon frühzeitig eine umweltpolitische Aufmerksamkeit auf sich. Lachgas hat einerseits medizinische (Anästhetikum) und technische Anwendungen, andererseits wird es bei technischen und landwirtschaftlichen Prozessen unbeabsichtigt in die Atmosphäre abgegeben.
Distickstofftrioxid ist in kondensierter Form (−21 °C) tiefblau und in fester Form (−102 °C) blassblau. Bei Temperaturen oberhalb 0 °C zerfällt die Verbindung in Stickstoffmonoxid und Stickstoffdioxid.
Formal können auch das Trinitramid (N(NO2)3 oder N4O6), das Nitrylazid (O2N–N3 oder N4O2) und das Nitrosylazid (ON–N3 oder N4O) den Stickstoffoxiden zugeordnet werden. Die Verbindungen sind äußerst instabil. Trinitramid[4] und Nitrylazid[5] konnten bisher nur in Lösung hergestellt und nachgewiesen werden. Nitrosylazid existiert unterhalb von −50 °C als schwach gelber Feststoff.[6] Weiterhin existieren noch das nur unterhalb von −142 °C beständige Nitratradikal (NO3, farblos), das auch in einer isomeren Peroxid-Form vorkommt, sowie das Dimer Distickstoffhexoxid (N2O6, O2N-O-O-NO2), das ebenfalls zu den Peroxiden zählt.[1]
| Oxidationsstufe von N | Summenformel | Bezeichnung |
|---|---|---|
| +0,5 | N4O | Nitrosylazid |
| +1 | N2O | Distickstoffmonoxid (Lachgas) |
| +1 | N4O2 | Nitrylazid |
| +2 | NO | Stickstoffmonoxid |
| +3 | N2O3 | Distickstofftrioxid |
| +3 | N4O6 | Trinitramid |
| +4 | NO2 | Stickstoffdioxid |
| +4 | N2O4 | Distickstofftetroxid |
| +5 | N2O5 | Distickstoffpentoxid |
Nitrose Gase entstehen unter anderem bei der Reaktion von Salpetersäure (HNO3) mit organischen Stoffen oder Metallen. So entstehen bei der Reaktion von Salpetersäure mit Silber und Kupfer große Mengen NOx. Die typisch rotbraune Farbe der nitrosen Gase wird im Wesentlichen durch das Stickstoffdioxid (NO2) hervorgerufen. Nitrose Gase haben einen charakteristischen stechenden Geruch und können mit Verzögerung von mehr als 24 Stunden (AerosolLatenzzeit) nach dem Einatmen noch zu einem Lungenödem führen.
Stickoxide in der Luft
Aus natürlichen und anthropogenen Quellen gelangen Stickoxide in die Atmosphäre.
Anthropogene Quellen


Eine der Hauptquellen für Stickoxide in der Atmosphäre sind Abgase, die bei der Verbrennung fossiler Brennstoffe, wie Kohle oder Öl, entstehen. In Europa wurden im Jahr 2000 mehr als die Hälfte, in einigen Städten, wie London, bis zu drei Viertel der NOx-Emissionen durch den Verkehr verursacht.[8] NOx-Konzentrationen direkt am Auspuff von Fahrzeugen bewegen sich zwischen 1000 mg/m³ und 5000 mg/m³.[9] Bereits seit den 1990er-Jahren sind die Emissionen allerdings kontinuierlich rückläufig. Nach Angabe des Umweltbundesamtes sanken die jährlichen Stickoxid-Emissionen in Deutschland in der Zeit von 1990 bis 2015 um 52 % von 2,887 auf 1,364 Mio. Tonnen.[10] In der Europäischen Union (EU28) verringerten sich die NOx-Emissionen in der Zeit von 1990 bis 2015 um 56 % von 17,664 auf 7,751 Mio. Tonnen. In dieser Zeit sank in der EU28 der Anteil des Verkehrs an den NOx-Emissionen auf 46 % (39 % Straßenverkehr und 7 % andere Verkehrsformen).[11][12] Davon stammen bis zu 80 % aus Dieselmotoren.[13] Die Emissionen durch die Schifffahrt tragen wesentlich dazu bei. So wird beispielsweise knapp ein Drittel der Stickoxidemissionen in Hamburg durch den Hafenbetrieb des Hamburger Hafens verursacht.[14]
Natürliche Quellen
Stickoxide entstehen auch aufgrund natürlicher atmosphärischer Vorgänge. Bereits 1997 kam eine Studie von Colin Price und seinen Kollegen zu dem Ergebnis, dass Blitze ganz erheblich zur Erzeugung von Stickoxiden in der Atmosphäre beitragen. Sie gingen dabei davon aus, dass weltweit pro Sekunde zwischen 60 und 120 Blitze auftreten, jahres- bzw. monatsabhängig.[15] Blitze entstehen vor allem über Land, und ihre Häufigkeit nimmt bei steigenden Temperaturen zu. Da sich aus den Stickoxiden zusammen mit Wasser Nitrate bilden, sind Blitze damit auch eine sehr bedeutende natürliche Quelle für die „Stickstoffdüngung“ von Wildpflanzen bzw. Plankton, die elementaren Stickstoff nicht verstoffwechseln können.
Entgegen bisheriger Annahmen entstehen die meisten Stickoxide aber nicht automatisch wegen der höheren Blitzfrequenz in den Tropen – neben der Häufigkeit ist auch die Blitzlänge für die Menge des erzeugten NOx maßgeblich.[16] Berechnungen, die aufgrund der ermittelten Blitzhäufigkeit und Wirkungen durchgeführt wurden, kamen zum Ergebnis, dass jährlich bis zu 20 Mio. Tonnen Stickoxide durch diese natürliche Ursache entstehen.[17] Nach einer 2003 veröffentlichten Studie werden (in den USA) im Sommer in der mittleren und oberen Troposphäre (zwischen 5 und 15 km) 90 % aller Stickoxide auf dieser Ursache beruhen. In der unteren Troposphäre (< 5 km) werden in den Sommermonaten bis zu 20 % der NOx Gesamtmenge durch Blitze erzeugt, während in den Wintermonaten die Menge vernachlässigbar ist.[18][19]
Auswirkungen von Stickoxiden
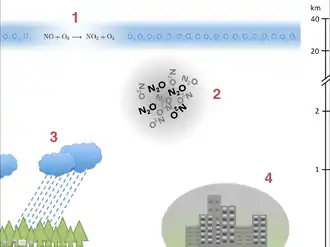
Stickoxide – insbesondere Stickstoffdioxid – reizen und schädigen die Atmungsorgane. Erhöhte Konzentrationen in der Atemluft haben einen negativen Effekt auf die Lungenfunktion von Kindern und Erwachsenen.[20] Sie sind zum Teil für die Entstehung des Sauren Regens mitverantwortlich, wobei Salpetersäure (HNO3) durch Reaktion von (2 NO2 + H2O → HNO3 + HNO2) oder durch Aufnahme von N2O5 in Aerosolpartikel und nachfolgender Bildung von NO3− in der flüssigen Phase entsteht.
Bodennahe Stickoxide sind beim sogenannten Sommersmog verantwortlich für die Ozonbildung (O3) unter Einfluss von UV-Strahlung der Sonne.[21]:
Da der Vorgang reversibel ist, ist die Ozonmenge an sonnigen Tagen am Nachmittag am höchsten und fällt über Nacht wieder ab.
Beim Transport der Schadstoffe von den Emissionszentren weg wandelt sich das NO zunehmend in NO2 um, wodurch die Bildungsreaktion von Ozon (1) beschleunigt und die Abbaureaktion (2) reduziert wird. Entsprechend können in ländlicheren Gebieten höhere Ozonwerte gemessen werden als in den Städten.[21]
Zum Schutz der menschlichen Gesundheit wurde der EU-Grenzwert als Jahresmittelwert für die Stickstoffdioxidkonzentration (NO2) in der Außenluft mit 40 µg/m³ festgelegt. Für bestimmte Arbeitsplätze in Industriebranchen und Gewerbe, bei dem deutlich höhere Stickoxidemissionen zu erwarten sind, gilt ein gesonderter Arbeitsplatzgrenzwert, der bis zu 950 µg/m³ erlaubt. Dieser Wert gilt ausschließlich für gesunde Arbeitskräfte und maximal an acht Stunden täglich und für maximal 40 Stunden in der Woche.[22]
Lachgas (N2O) ist ein Treibhausgas und trägt zur Erderwärmung bei. Seine Treibhauswirksamkeit ist auf einem Zeithorizont von 100 Jahren 298-mal so groß wie die von CO2.[23]
Stickoxide aus dem Flugverkehr und indirekt auch Lachgas tragen zum Ozonabbau in der Stratosphäre bei.[24] Lachgas wird durch UV-Strahlung photolysiert und bildet dabei NO, welches entsprechend der Gleichung (2) wiederum Ozon abbaut.
NOx in der Feuerung
Stickoxide werden in der Regel entsprechend ihren Quellen und ihrem Bildungsmechanismus in 3 Arten unterteilt:
- thermisches NOx
- Brennstoff-NOx (englisch fuel-NOx)
- promptes NOx
Die in diesem Zusammenhang erwähnten „NOx“ setzen sich in der Feuerung zu etwa 95 % NO und 5 % NO2 zusammen. Mit Hilfe der Reaktionskinetik lässt sich die Änderung der Konzentrationen des NOx beschreiben. Hierbei sind die Konzentrationen von N2 und O als auch die Temperatur maßgebliche Einflussfaktoren:
Der Exponentialterm ist der Ansatz über die Arrhenius-Gleichung, cN2 und cO sind die Konzentrationen von N2 und O zum jeweiligen Zeitpunkt.
Thermisches NOx
Die Bezeichnung „thermisch“ bezieht sich auf die relativ hohen Temperaturen, die zur Initiierung der Bildungsreaktion des thermischen NOx über N2 benötigt werden. Die Stickstoffquelle des thermischen NOx ist der in der Verbrennungsluft vorhandene Stickstoff, der zur Oxidation des N2 nötige Sauerstoff entstammt ebenfalls der Verbrennungsluft. Zeldovich beschreibt die Entstehung in zwei beziehungsweise drei Schritten, das Schema ist als einfacher beziehungsweise erweiterter „Zeldovich-Mechanismus“ bekannt.
Startreaktion ist die Umsetzung von Luftstickstoff mit atomarem Sauerstoff, in der Stickstoffradikale entstehen. Diese oxidieren in der zweiten Reaktion weiter:
- (1)
- (2)
Der dritte Schritt berücksichtigt, dass die bei der Verbrennung entstehenden Hydroxyl-Radikale (OH) bei Sauerstoffmangel ebenfalls mit Stickstoff reagieren können (Reaktion in der Flammzone):
- (3)
Mit der Bildung von thermischem NOx ist bei Verbrennungstemperaturen ab etwa 1000 °C zu rechnen, die Bildungsrate von NO nimmt ab etwa 1200 °C exponentiell zu. Kühlt das Gas auf unterhalb 600 °C ab, so wird es zu NO2 oxidiert.[25] Unterhalb 1000 °C dominiert bei stickstoffhaltigen Brennstoffen das so genannte Brennstoff-NOx. Ebenso haben der angebotene Sauerstoff und die Verweilzeit der Reaktionspartner in der Verbrennungszone einen Einfluss auf die NOx-Entstehungsrate. Hohe Drücke, wie sie zum Beispiel in Verbrennungsmotoren auftreten, begünstigen ebenfalls die NOx-Bildung. Untersuchungen zur Stickoxidbildung am Lichtbogenofen belegen, dass neben den technischen Verbrennungsprozessen fossiler Brennstoffe wie Erdöl oder Erdgas auch O2/N2-Plasmen gute Bildungsbedingungen für Stickoxide aufweisen.
Brennstoff-NOx
Quelle dieser NOx-Art sind die im Brennstoff gebundenen Anteile an Stickstoff, die während der Verbrennung in NOx umgesetzt werden. Die mitgeführte Menge an Stickstoff ist stark brennstoffabhängig; dementsprechend variieren auch die durch die Verbrennung entstehenden Anteile von thermischem und Brennstoff-NOx im Rauchgas.
Einige Beispiele sind (Anteile in %):
Brennstoff therm. NOx BS-NOx aus flüchtigen
BestandteilenBS-NOx
aus KoksPrompt-NOx Diesel/Benzin
Innermotorisch90–95 – – 5–10 Gas 100 – – – Schweröl 40–60 40–60 – – Steinkohle
Trockenfeuerung10–30 50–70 20–30 – Steinkohle
Schmelzfeuerung40–60 30–40 10–20 – Braunkohle <10 >80 <10 –
Man unterscheidet bei festen Brennstoffen zwei Arten der Stickstofffreisetzung. Die homogene Freisetzung beschreibt die Ausgasung des im Brennstoff gebundenen Stickstoffs mit den flüchtigen Bestandteilen, während die heterogene den Abbrand zum Beispiel des Restkoks beschreibt.
Wesentliche Quelle für Brennstoff-NOx sind die flüchtigen Bestandteile des Brennstoffes.
Brennstoff-NOx entsteht ab Temperaturen um etwa 800 °C vorwiegend in den Flammenfronten der Feuerungsanlagen. Hierbei durchläuft der mitgeführte Brennstoff mehrere Reaktionsschritte, die über Blausäure (HCN) und Hydrazin (NHn) zu NO und N2 führen. N2 und NO können mit Kohlenwasserstoff-Radikalen (CHn) eine Rückreaktion zu HCN durchlaufen („Reburning“) und hierbei wieder zu NO oder aber zu molekularem Stickstoff (N2) umsetzen. Dadurch erhöht sich in der Summe die Menge an molekularem Stickstoff. Diesen Effekt macht man sich in der so genannten „Brennstoff-Stufung“, einer primären Schadstoff-Minderungsmaßnahme, zu Nutze.
Promptes NOx
Statt der Umsetzung zu N2 kann die Reaktion der Brennstoffradikale (CHn) mit N2 wieder zur Bildung von NOx führen. Diesen Anteil an entstandenem NOx bezeichnet man als „promptes“ NOx und ist auch als „Fenimore-Mechanismus“ bekannt.
Wesentlicher Einflussfaktor sind die entstehenden Kohlenwasserstoff-Radikale, die als Zwischenprodukte der Verbrennung kohlenstoffhaltiger fossiler Brennstoffe vorliegen. Deren Bildungsmechanismen sind äußerst komplex und bisher noch nicht vollständig erfasst und verstanden. Promptes NOx entsteht in sehr schnellen Bildungsreaktionen in vergleichbar geringen Mengen und ist im Vergleich zum thermischen NOx kaum temperaturabhängig, wenngleich der Anteil mit steigender Temperatur zunimmt.
NOx-Minderung
In den Kraftwerken gibt es verschiedene Möglichkeiten der NOx-Minderung.
Die Primärmaßnahmen betreffen den Feuerungsprozess und verhindern die Entstehung von NOx. Dazu gehören Luftstufung, Brennstoffstufung, interne Abgasrückführung, externe Abgasrückführung, Primäradditivierung sowie Quenchen (Eindüsung von Wasser zur Temperatur-Minderung).
Die Sekundärmaßnahmen mindern das NOx im Abgas durch katalytische (SCR-Verfahren) oder nichtkatalytische (SNCR-Verfahren) Reduktion zu elementarem Stickstoff. Auch für die Abgase von Kraftfahrzeugen kommt die katalytische Abgasreinigung zum Einsatz. Hauptprodukte der dargestellten Reduktionsmaßnahmen sind elementarer Stickstoff, wie er zu ca. 78 Vol.-% in der Luft vorkommt, sowie Wasser. Als Nebenreaktionen können geringe Mengen an Lachgas entstehen. Außerdem können sowohl bei den katalytischen[26] als auch bei den nichtkatalytischen[27] Sekundärmaßnahmen geringe Mengen an Ammoniak entweichen (NH3-Schlupf).
Natürlicher NOx-Abbau
Die Vorgänge in der Atmosphäre, bei denen Stickoxide gebildet und abgebaut werden, sind äußerst kompliziert. Sie bestehen aus einer Vielzahl von Reaktionen, die in unterschiedlichem Maße durch die herrschende Temperatur, die Sonnenlichtstärke, den Druck, durch Verschmutzungen und die jeweiligen Konzentrationsverhältnisse beeinflusst werden. Beim Aufsteigen der Moleküle in die Atmosphäre sinkt zum Beispiel einerseits die Reaktionswahrscheinlichkeit durch abnehmenden Druck, andererseits entfällt dabei aber auch ein Teil der Zusammenstöße mit unreaktiven Molekülen und die Strahlung nimmt an Intensität zu. Deswegen ändert sich die Halbwertszeit der an den Reaktionen beteiligten Stoffe mit der Höhe, und manche Zwischenprodukte, die in Bodennähe nur sehr kurzlebig sind, sind in der Stratosphäre sehr viel beständiger. Andererseits können Verbindungen wie Distickstoffoxid, die am Boden relativ reaktionsträge sind, langsam in die Stratosphäre aufsteigen, wo sie schließlich mit anderen Verbindungen reagieren.[28] Die typische (aber hochgradig variable) Lebensdauer von NOx beträgt einige Stunden für die untere und einige Tage für die obere Troposphäre.[29] In der Stratosphäre und Mesosphäre beträgt die typische Lebensdauer von Tagen bis wenige Wochen.[30]
Salpetrige Säure könnte in der Atmosphäre durch die wahrscheinlich heterogene Reaktion entstehen.[31]
Allerdings unterliegt sie dann der Photolyse, weshalb sie in vielen chemischen Modellen als Quelle für OH-Radikale angesehen wird.[31]
Distickstoffpentoxid kann als Zwischenprodukt in der Atmosphäre auftreten. Es entsteht zum Beispiel aus Stickstoffdioxid und Stickstofftrioxid.[31]
Als Anhydrid der Salpetersaure reagiert es mit Wasser(dampf) zu Salpetersäure, wobei die Geschwindigkeit der Reaktion in der Gasphase nicht genau bekannt ist.[31]
Man nimmt an, dass die Reaktion in erster Linie heterogen an feuchten Aerosolen erfolgt. Von großer Bedeutung ist auch die Salpetersäurebildung in der Atmosphäre gemäß der Reaktion:[31]
Die Reaktion verläuft bei 25 °C etwa zehnmal schneller als die Rekombination von OH-Radikalen mit Schwefeldioxid.[31] Salpetersäure kann aber auch dauerhaft aus dem Reaktionskreislauf entfernt werden, zum Beispiel durch Anlagerung an Aerosolpartikel oder auch durch Neubildung (Kondensation) solcher Teilchen.[32] Die gasförmige Salpetersäure ist in der bodennahen Troposphäre chemisch sehr stabil und wird wegen ihrer guten Wasserlöslichkeit durch trockene und nasse Deposition aus der Atmosphäre entfernt.[33]
Stickstofftrioxid wiederum ist ein bedeutender Bestandteil der nächtlichen reinen und verunreinigten Troposphäre. Am Tage unterliegt die Verbindung der Photolyse:
Außerdem reagiert Stickstofftrioxid rasch mit Stickstoffmonoxid zu Stickstoffdioxid:[31]
Die Lebensdauer von Stickstofftrioxid beträgt deshalb am Tage weniger als 10 s. Einflussfaktoren für diese Reaktionen sind die Ozonkonzentration, die Lichtintensität (Sonne), die Verweilzeit der Verbindungen in der Atmosphäre, die Luftverschmutzung (zum Beispiel Staub, Schwefeldioxid) und die Smogbildung.[31]
Messtechnischer Nachweis von Stickstoffoxiden
Emissionsmessung
Bei der Messung von Stickstoffoxiden in Abgasen aus stationären Quellen können Chemilumineszenz-Verfahren zum Einsatz kommen. Dazu wird die Eigenschaft von Stickstoffmonoxid genutzt, bei der Umwandlung in Stickstoffdioxid Licht auszusenden (Chemilumineszenz).[34] Aus dem Abgas wird ein repräsentativer Teilstrom entnommen und nach Durchlaufen eines Konverters, der möglicherweise vorhandenes Stickstoffdioxid in Stickstoffmonoxid umwandelt, mit Ozon in Verbindung gebracht. Das bei der Reaktion ausgesendete Licht wird von einem Photomultiplier in ein elektrisches Signal umgewandelt, das Aufschluss über die Stickstoffoxid-Konzentration gibt.[34]
Zur Bestimmung von Stickstoffmonoxid und Stickstoffdioxid mittels Ionenaustauschchromatographie werden diese Gase mithilfe von Ozon oder Wasserstoffperoxid und Wasser in Salpetersäure umgewandelt. Analysiert wird im Anschluss die Nitrat-Konzentration.[35]
Weitere Verfahren zur Messung von Stickstoffoxiden in Abgasen aus stationären Quellen sind das Natriumsalicylatverfahren und das Dimethylphenolverfahren. Beim Natriumsalicylatverfahren werden Stickstoffmonoxid und Stickstoffdioxid zu Salpetersäure oxidiert und anschließend mit Natriumsalicylat in Nitrosalicylsäure umgewandelt. Die Konzentration des sich nach einem weiteren Behandlungsschritt bildenden gelben Anions der Nitrosalicylsäure kann photometrisch bestimmt werden und damit Aufschluss über die Stickstoffoxid-Konzentration des beprobten Gases geben.[36] Für das Dimethylphenolverfahren werden Stickstoffmonoxid und Stickstoffdioxid mittels Ozon in der Gasphase zu Distickstoffpentoxid oxidiert, das nach Absorption in Wasser mit 2,6-Dimethylphenol in schwefelsaurer und phosphorsaurer Lösung zu 2,6-Dimethyl-4-nitrophenol umgewandelt wird, dessen Anion ebenfalls photometrisch vermessen werden kann.[37]
Ein Verfahren zur Bestimmung von Distickstoffmonoxid in Abgasen aus stationären Quellen ist das nicht-dispersive Infrarot-Verfahren. Dazu werden das sich in einer Messgaszelle befindliche Gas und eine Referenzzelle von einem Infrarotstrahler durchleuchtet.[38] Beide Strahlen werden von einem Empfänger detektiert und miteinander verglichen. Der im Vergleich zur Referenzzelle abgeschwächte Strahl ist ein Maß für die Distickstoffmonoxid-Konzentration. Um Querempfindlichkeiten des Verfahrens durch störendes Kohlenstoffmonoxid zu minimieren, wird es mittels eines aus Metalloxiden bestehenden Konverters in Kohlenstoffdioxid umgewandelt.[39]
Wichtig ist, dass alle Komponenten der Messeinrichtung, die mit dem zu beprobenden Gas in Kontakt treten, nicht mit den Stickstoffoxiden reagieren.[34]
Immissionsmessung

Bei der Immissionsmessung von Stickstoffdioxid kann das Saltzman-Verfahren angewendet werden, bei dem die Probenluft durch eine Reaktionslösung geleitet wird, die mit der zu detektierenden Gaskomponente zu einem roten Azofarbstoff reagiert.[40] Die Farbintensität der Reaktionslösung wird photometrisch bestimmt und ist ein Maß für die Masse an Stickstoffdioxid.[41] Durch Einsatz eines Oxidationsmittels kann das Saltzman-Verfahren auch zur Ermittlung von Stickstoffmonoxid Verwendung finden.[42]
Ebenso wie bei der Emissionsmessung können auch bei der Immissionsmessung Chemilumineszenz-Verfahren zum Einsatz kommen.[43]
Eine weitere Möglichkeit der Immissionsmessung von Stickstoffdioxid ist die Verwendung von Passivsammlern. In einem nach unten geöffneten Glasröhrchen befindet sich ein mit Triethanolamin präpariertes Drahtnetz, auf dem Stickstoffdioxid abgeschieden wird. Das Drahtnetz wird nach Ende der Sammelzeit mit einer Kombinationsreagenz versetzt, um die entstehende Verfärbung photometrisch zu analysieren.[44]
Literatur
- Erich Fitzer, Dieter Siegel: Stickoxid-Emissionen industrieller Feuerungsanlagen in Abhängigkeit von den Betriebsbedingungen. In: Chemie Ingenieur Technik. Nr. 47(13), 1975, S. 571.
- Rainer Römer, Wolfgang Leckel, Alfred Stöckel, Gerd Hemmer: Beeinflussung der Stickoxid-Bildung aus brennstoffgebundenem Stickstoff durch feuerungstechnische Maßnahmen. In: Chemie Ingenieur Technik. Nr. 53(2), 1981, S. 128–129.
- Heinrich Wilhelm Gudenau, Klaus E. Herforth: Stickoxid-Bildung bei der Umsetzung fester Brennstoffe in verschiedenen Gasmedien. In: Chemie Ingenieur Technik. Nr. 53(9), 1981, S. 742–743.
- Manfred Schrod, Joachim Semel, Rudolf Steiner: Verfahren zur Minderung von NOx-Emissionen in Rauchgasen. In: Chemie Ingenieur Technik. Nr. 57(9), 1985, S. 717–727.
- Hans-Georg Schäfer, Fred N. Riedel: Über die Bildung von Stickoxiden in Großfeuerungsanlagen, deren Einfluß auf die Umwelt, ihre Verminderung sowie ihre Entfernung aus den Abgasen der Kraftwerke. In: Chemiker-Zeitung. Nr. 113(2), 1989, S. 65–72.
- Ulrich Förstermann: Stickoxid (NO): Umweltgift und körpereigener Botenstoff. In: Biologie in unserer Zeit. Nr. 24(2), 1994, S. 62–69, doi:10.1002/biuz.19940240203.
Weblinks
- Umweltbundesamt:
- wissenschaft.de: Was dreckige Fenster mit Smog zu tun haben.
Einzelnachweise
- Eintrag zu Stickstoffoxide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. September 2015.
- Eintrag zu Nitrose Gase. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. September 2015.
- Roy M. Harrison: Principles of Environmental Chemistry. RSC 2007, ISBN 978-0-85404-371-2, eingeschränkte Vorschau in der Google-Buchsuche.
- Rahm, M.; Dvinskikh, S.V.; Furo, I.; Brinck, T.: Experimental Detection of Trinitramide, N(NO3)3 in Angewandte Chemie 123 (2011), S. 1177–1180, doi:10.1002/ange.201007047.
- Klapötke, T.M.; Schulz, A.; Tornieporth-Oetting, I.C.: Studies of the Reaction Behavior of Nitryl Compounds Towards Azides: Evidence for Tetranitrogen Dioxide, N4O2 in Chemische Berichte 127 (1994), S. 2181–2185, doi:10.1002/cber.1491271115.
- Schulz, A.; Tornieporth-Oetting, I.C.; Klapötke, T.M.: Nitrosyl Azide, N4O, an Intrinsically Unstable Oxide of Nitrogen in Angew. Chem. Int. Ed. 32 (1993), S. 1610–1612, doi:10.1002/anie.199316101
- Mobilitätsatlas 2019 – Daten und Fakten für die Verkehrswende, dort S. 29
- WHO Regional Office for Europe: Health Aspects of Air Pollution with Particulate Matter, Ozone and Nitrogen Dioxide. In: euro.who.int. World Health Organization, 10. April 2013, abgerufen am 30. Dezember 2019.
- VDI 3783 Blatt 19:2017-04 Umweltmeteorologie; Reaktionsmechanismus zur Bestimmung der Stickstoffdioxid-Konzentration (Environmental meteorology; Reaction mechanism for the determination of the nitrogen dioxide concentration). Beuth Verlag, Berlin, S. 23.
- Stickstoffoxid-Emissionen. In: umweltbundesamt.de. Abgerufen am 16. Dezember 2020. Minderung um rund 59 % in der Zeit 1990 bis 2018 auf 1,198 Mio. Tonnen, siehe auch Diagramm Stickstoff-Emissionen nach Quellkategorien Stand 2/2020
- European Union emission inventory report 1990–2015 under the UNECE Convention on Long-range Transboundary Air Pollution (LRTAP). In: eea.europa.eu. 11. Juli 2017, abgerufen am 28. Februar 2018 (englisch).
- Air quality in Europe — 2017 report. In: eea.europa.eu. 25. August 2017, abgerufen am 7. Oktober 2018 (englisch).
- Air quality in Europe — 2015 report. In: eea.europa.eu. 12. November 2015, abgerufen am 7. Oktober 2018 (englisch).
- Kerstin Viering: Es liegt was in der Luft. In: helmholtz.de. 31. Mai 2019, abgerufen am 15. Juli 2019.
- Colin Price, Joyce Penner, Michael Prather: NOx from lightning: 1. Global distribution based on lightning physics. In: Journal of Geophysical Research: Atmospheres. Band 102, D5, 20. März 1997, S. 5929–5941, doi:10.1029/96JD03504.
- Heidi Huntrieser, Ulrich Schumann am Deutschen Zentrum für Luft- und Raumfahrt: Blitze und Stickoxide in den stärksten Gewitterwolken der Welt (pdf)
- stre: Gewitter erzeugen jährlich bis zu 20 Millionen Tonnen umweltschädlicher Stickoxide: Blitze machen den Regen sauer. In: berliner-zeitung.de. 6. Februar 2017, abgerufen am 6. Februar 2017.
- R. Zhang, X. Tie, D. W. Bond: Impacts of anthropogenic and natural NOx sources over the U.S. on tropospheric chemistry. In: Proceedings of the National Academy of Sciences of the United States of America. 100, 2003, S. 1505–1509, doi:10.1073/pnas.252763799. (pdf)
- NASA – Top Story – SURPRISE! LIGHTNING HAS BIG EFFECT ON ATMOSPHERIC CHEMISTRY – March 19, 2003. In: nasa.gov. 19. März 2003, abgerufen am 6. Februar 2017.
- Health Aspects of Air Pollution with Particulate Matter,Ozone and Nitrogen Dioxide (PDF; 558 kB), Report on a WHO Working Group, Bonn, Deutschland, 13. bis 15. Januar 2003 (englisch).
- UmweltWissen – Schadstoffe Bodennahes Ozon und Sommersmog. Bayerisches Landesamt für Umwelt (PDF-Datei).
- Umweltbundesamt: Unterschied zwischen Außenluft- und Arbeitsplatzgrenzwert für NO2.
- Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change [Solomon, S., D. Qin, M. Manning, Z. Chen, M. Marquis, K.B. Averyt, M. Tignor and H.L. Miller (eds.)], Chapter 2, Table 2.14. Cambridge University Press, Cambridge, United Kingdom and New York, NY, USA. (PDF; 18,6 MB) (Memento vom 27. Mai 2018 im Internet Archive)
- A. R. Ravishankara, J. S. Daniel, R. W. Portmann: Nitrous oxide (N2O): the dominant ozone-depleting substance emitted in the 21st century. In: Science. Band 326, Nummer 5949, Oktober 2009, S. 123–125, doi:10.1126/science.1176985. PMID 19713491.
- Fritz Baum: Luftreinhaltung in der Praxis. Oldenbourg Wissenschaftsverlag, München 1988, ISBN 3-486-26256-4, S. 86.
- VDI 3476 Blatt 3:2012-01 Abgasreinigung; Verfahren der katalytischen Abgasreinigung; Selektive katalytische Reduktion (Waste gas cleaning; Methods of catalytic waste gas cleaning; Selective catalytic reduction). Beuth Verlag, Berlin, S. 26.
- VDI 3927 Blatt 1:2015-11 Abgasreinigung; Minderung von Schwefeloxiden, Stickstoffoxiden und Halogeniden aus Abgasen von Verbrennungsprozessen (Rauchgasen) (Waste gas cleaning; Reduction of sulphur oxides, nitrogen oxides and halides from combustion flue gases). Beuth Verlag, Berlin, S. 73.
- Alan R. Wellburn: Luftverschmutzung und Klimaänderung Auswirkungen auf Flora, Fauna und Mensch. Springer-Verlag, 2013, ISBN 978-3-642-59037-5, S. 73 (eingeschränkte Vorschau in der Google-Buchsuche).
- Steffen Beirle: Estimating source strengths and lifetime of Nitrogen Oxides from satellite data. (2004), doi:10.11588/heidok.00005225.
- F. Friederich, T. von Clarmann u. a.: Lifetime and production rate of NOx in the upper stratosphere and lower mesosphere in the polar spring/summer after the solar proton event in October–November 2003. In: Atmospheric Chemistry and Physics. 13, 2013, S. 2531–2539, doi:10.5194/acp-13-2531-2013.
- Jörgen Kolar: Stickstoffoxide und Luftreinhaltung Grundlagen, Emissionen, Transmission, Immissionen, Wirkungen. Springer-Verlag, 2013, ISBN 978-3-642-93418-6, S. 15 (eingeschränkte Vorschau in der Google-Buchsuche).
- Walter Roedel, Thomas Wagner: Physik unserer Umwelt: Die Atmosphäre. Springer-Verlag, 2010, ISBN 978-3-642-15729-5, S. 416 (eingeschränkte Vorschau in der Google-Buchsuche).
- Karl H. Becker, Jürgen Löbel: Atmosphärische Spurenstoffe und ihr physikalisch-chemisches Verhalten Ein Beitrag zur Umweltforschung. Springer-Verlag, 2013, ISBN 978-3-642-70531-1, S. 69 (eingeschränkte Vorschau in der Google-Buchsuche).
- DIN EN 14792:2006-04 Emissionen aus stationären Quellen; Bestimmung der Massenkonzentration von Stickstoffoxiden (NOx); Referenzverfahren: Chemilumineszenz; Deutsche Fassung EN 14792:2005. Beuth Verlag, Berlin, S. 10–11.
- VDI 2456:2004-11 Messen gasförmiger Emissionen; Referenzverfahren für die Bestimmung der Summe von Stickstoffmonoxid und Stickstoffdioxid; Ionenchromatographisches Verfahren (Stationary source emissions; Reference method for determination of the sum of nitrogen monoxide and nitrogen dioxide; Ion chromatography method). Beuth Verlag, Berlin, S. 3–4.
- VDI 2456 Blatt 8:1986-01 Messen gasförmiger Emissionen; Analytische Bestimmung der Summe von Stickstoffmonoxid und Stickstoffdioxid; Natriumsalicylatverfahren (Gaseous emission measurement; analytical determination of the sum of nitrogen monoxide and nitrogen dioxide; sodium salicylate method). VDI-Verlag, Düsseldorf, S. 2.
- VDI 2456 Blatt 10:1990-11 Messen gasförmiger Emissionen; Analytische Bestimmung der Summe von Stickstoffmonoxid und Stickstoffdioxid; Dimethylphenolverfahren (Gaseous emission measurement; analytical determination of the sum of nitrogen monoxide and nitrogen dioxide; dimethylphenol method). Beuth Verlag, Berlin, S. 2.
- DIN EN ISO 21258:2010-11 Emissionen aus stationären Quellen; Bestimmung der Massenkonzentration von Distickstoffmonoxid (N2O); Referenzverfahren: Nicht-dispersives Infrarot-Verfahren (ISO 21258:2010); Deutsche Fassung EN ISO 21258:2010. Beuth Verlag, Berlin, S. 20.
- DIN EN ISO 21258:2010-11 Emissionen aus stationären Quellen; Bestimmung der Massenkonzentration von Distickstoffmonoxid (N2O); Referenzverfahren: Nicht-dispersives Infrarot-Verfahren (ISO 21258:2010); Deutsche Fassung EN ISO 21258:2010. Beuth Verlag, Berlin, S. 11.
- VDI 2453 Blatt 1:1990-10 Messen gasförmiger Immissionen; Messen der Stickstoffdioxid-Konzentration; Manuelles photometrisches Basis-Verfahren (Saltzmann) (Gaseous air pollution measurement; determination of nitrogen dioxide concentration; photometric manual standard method (Saltzmann)). Beuth Verlag, Berlin, S. 3.
- Franz Joseph Dreyhaupt (Hrsg.): VDI-Lexikon Umwelttechnik. VDI-Verlag Düsseldorf 1994, ISBN 3-18-400891-6, S. 1005–1006.
- VDI 2453 Blatt 2:1974-01 Messung gasförmiger Immissionen; Bestimmen von Stickstoffmonoxid; Oxidation zu Stickstoffdioxid und Messung nach dem photometrischen Verfahren (Saltzman). VDI-Verlag, Düsseldorf, S. 2.
- Franz Joseph Dreyhaupt (Hrsg.): VDI-Lexikon Umwelttechnik. VDI-Verlag Düsseldorf 1994, ISBN 3-18-400891-6, S. 1130.
- H.-J. Moriske, M. Schöndube: Einsatz von Stickstoffdioxid (NO2)-Passivsammlern für verkehrsbezogene Immissionsmessungen. In: Kommission Reinhaltung der Luft im VDI und DIN (Hrsg.): Aktuelle Aufgaben der Messtechnik in der Luftreinhaltung. VDI-Verlag Düsseldorf 1996, ISBN 3-18-091257-X, S. 341–354.