Smiles-Umlagerung
Die Smiles-Umlagerung ist eine organisch-chemische Reaktion und gehört zu den Umlagerungsreaktionen.[1] Sie ist nach Samuel Smiles benannt, der sie 1931 beschrieb.

Es handelt sich um eine intramolekulare, nucleophile aromatische Substitution. Bei der Gruppe X kann es sich hier um ein Sulfon, Sulfid, Ether oder andere elektronenziehende Substituenten handeln. Die Gruppe Y muss ein starkes Nucleophil sein wie etwa Phenol-Sauerstoffatom, Aminstickstoff-Atom oder Schwefel. Wie bei anderen nucleophilen Substitutionen an Aromaten muss dieser durch weitere elektronenziehende Gruppen in ortho- oder para-Position zur Gruppe X aktiviert werden.
Eine Variante der Smiles-Umlagerung ist als Truce-Smiles-Umlagerung bekannt. Hier ist das Nucleophil Y so stark, dass der Aromat keine weiteren aktivierenden Gruppen enthalten muss. Als Nucleophile dienen hier Organolithium-Verbindungen.[2]
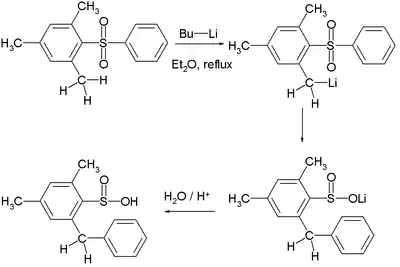
Die Reaktion nutzt die ortho-Sulfongruppe aus um das Anion durch eine ortho-Metallierung als Nucleophil zu erzeugen.
Eine ähnliche Umlagerungsreaktion ist als Chapman-Umlagerung bekannt.[3]
Einzelnachweise
- A.A. Levy, H.C. Rains and S. Smiles, J. Chem. Soc. 1931, 3264.
- W.E. Truce, W.J. Ray, O.L. Norman, and D.B. Eickemeyer: In 'Rearrangements of Aryl Sulfones. I. The Metalation and Rearrangement of Mesityl Phenyl Sulfone' J. Am. Chem. Soc. 1958, 80, 3625 – 3629 doi:10.1021/ja01547a038.
- A.W. Chapman: In CCLXIX. - Imino-aryl ethers. Part III. The molecular rearrangement of N-phenylbenziminophenyl ether J. Chem. Soc., Transactions, 1925, 127, 1992–1998.
Weblinks
- Masahiro Mizuno and Mitsuhisa Yamano: A new practical One-Pot Conversion of Phenols to Anilines: 6-Amino-3,4-Dihydro-1(2H)-Naphthalenone In: Organic Syntheses. 84, 2007, S. 325–333, doi:10.15227/orgsyn.084.0325 (PDF).