Siliciumdisulfid
Siliciumdisulfid ist eine anorganische chemische Verbindung des Siliciums aus der Gruppe der Sulfide.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
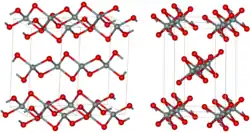 | ||||||||||||||||
| _ Si4+ _ S2− | ||||||||||||||||
| Raumgruppe |
Ibam (Nr. 72) | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Siliciumdisulfid | |||||||||||||||
| Andere Namen |
Silicium(IV)-sulfid | |||||||||||||||
| Verhältnisformel | SiS2 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff mit Geruch nach faulen Eiern[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 92,21 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
2,02 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
Zersetzung in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Vorkommen
Es wird vermutet, dass Siliciumdisulfid in zirkumstellaren Hüllen vorkommt.[2]
Gewinnung und Darstellung
Siliciumdisulfid kann durch Reaktion von Siliciumdioxid mit Aluminiumsulfid bei 1200 bis 1300 °C gewonnen werden, wobei auch Siliciummonosulfid entsteht.[3]
Ebenfalls möglich ist die Darstellung durch Reaktion von trockenem Schwefelwasserstoff mit Silicium bei 1200 bis 1300 °C oder die thermische Zersetzung von Tetraethylmercaptosilan Si(SC2H5)4 bei 250 bis 300 °C.[3] Auch beim Zusammenschmelzen der Elemente bei 1000 °C entsteht es.[4]
Eigenschaften
Siliciumdisulfid ist eine weiße, faserige Masse, die sehr feuchtigkeitsempfindlich ist und sich in Wasser, Ethanol[4] und Ammoniak[4] zersetzt.[3]
Beim Erhitzen an der Luft verbrennt es langsam.[3] Es besitzt nicht wie Siliciumdioxid eine Raumnetz-, sondern eine Faserstruktur mit verzerrt tetraedrisch koordinierten Siliciumatomen. Es ist eine verzerrt kubisch dichteste Kugelpackung in der je ein Viertel der tetraedrischer Lücken durch Siliciumatome besetzt ist.[5] Es ist eine orthorhombische Kristallstruktur mit der Raumgruppe Ibam (Raumgruppen-Nr. 72).[6] Beim Erhitzen unter Druck geht diese in eine Cristobalit-artige Modifikation über.[4]

Einzelnachweise
- Datenblatt Silicon(IV) sulfide, 95% bei Alfa Aesar, abgerufen am 6. Januar 2014 (Seite nicht mehr abrufbar).
- Goebel, J. H. (1993): SiS2 in Circumstellar Shells. Astronomy and Astrophysics 278 (1): 226–230. bibcode:1993A&A...278..226G.
- Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band 1. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 699.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 916.
- von Will Kleber, Hans-Joachim Bautsch, Joachim Bohm: Einführung in die Kristallographie - Will Kleber, Hans-Joachim Bautsch, Joachim Bohm. Oldenbourg Verlag, 2010, ISBN 3-486-59885-6, S. 157 (eingeschränkte Vorschau in der Google-Buchsuche).
- Jean d’Ans, Ellen Lax, Roger Blachnik: Taschenbuch für Chemiker und Physiker. Springer DE, 1998, ISBN 3-642-58842-5, S. 734 (eingeschränkte Vorschau in der Google-Buchsuche).

