Setmelanotid
Setmelanotid (Imcivree, Hersteller Rhythm Pharmaceuticals) ist ein Arzneistoff zur Behandlung von Adipositas und zur Kontrolle des Hungergefühls, das durch bestimmte genetische Erkrankungen verursacht wird, nämlich dem Bardet-Biedl-Syndrom (BBS), Pro-Opiomelanocortin (POMC)-Mangel und Leptin-Rezeptor (LEPR)-Mangel.[2][3] Es ist der erste zugelassene Vertreter („First-in-class“) einer vergleichsweise neuen Wirkstoffklasse. Setmelanotid ist ein α-MSH-Mimetikum, resp. selektiver Melanocortin-4-Rezeptor (MC4R)-Agonist.[4] Patienten mit POMC- oder LEPR-Mangel haben ständig Hunger und entwickeln daher schon im Kindesalter eine Adipositas.[5]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
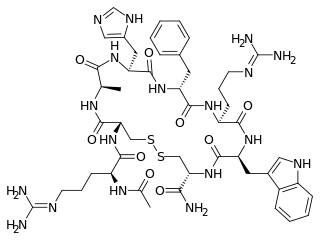 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Setmelanotid | |||||||||||||||
| Summenformel | C49H58N18O9S2 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
A08AA12 | |||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 1117,32 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Setmelanotid hat Orphan-Drug-Status, d. h.: es ist ein Arzneimittel gegen eine seltene Krankheit.[2][3] Imcivree ist sowohl in den USA als auch innerhalb der EU zugelassen.[2][6]
Anwendungsgebiete
Imcivree wird angewendet bei Erwachsenen und Kindern ab 6 Jahren zur Behandlung von Adipositas und zur Kontrolle des Hungergefühls im Zusammenhang mit genetisch bestätigtem Bardet-Biedl-Syndrom (BBS), durch Funktionsverlustmutationen bedingtem biallelischem Proopiomelanocortin (POMC)-Mangel (einschließlich PCSK1) oder biallelischem Leptinrezeptor (LEPR)-Mangel.[3]
Gegenanzeigen und Nebenwirkungen
Die häufigsten Nebenwirkungen sind Hyperpigmentierungsstörungen (56 %), Reaktionen an der Injektionsstelle (45 %), Übelkeit (31 %) und Kopfschmerzen (20 %).[3]
Wirkungsmechanismus
Personen mit POMC-Mangel haben niedrige Konzentrationen von Pro-Opiomelanocortin, einer Substanz, die in mehrere Hormone umgewandelt wird, einschließlich des Melanozyten-stimulierenden Hormons (MSH). Niedrige MSH-Spiegel führen zu einem Verlust des Sättigungsgefühls nach dem Essen. Bei Menschen mit LEPR-Mangel und BBS wirkt der Rezeptor für das Hormon Leptin nicht richtig, so dass Signale an die Nerven, die für das Sättigungsgefühl sorgen und Hungergefühle kontrollieren, nicht gesendet werden können. Personen mit POMC- und LEPR-Mangel und BBS fühlen sich kontinuierlich hungrig und nehmen schnell an Gewicht zu. Setmelanotid bindet an und aktiviert einen Rezeptor namens Melanocortin-Rezeptor 4, der normalerweise durch Leptin und MSH aktiviert wird, wodurch nach dem Essen ein Sättigungsgefühl gefördert wird. Durch die direkte Bindung an diesen Rezeptor wird davon ausgegangen, dass Imcivree die übermäßige Nahrungsaufnahme und so die Adipositas reduziert.[2][7]
Sonstige Informationen
Geschichtliches / Zulassungen
Setmelanotid hat Orphan-Drug-Status, das heißt es ist ein Arzneimittel gegen eine seltene Krankheit.[2][3][8][9][10] In den USA wurde Imcivree im November 2020 zugelassen.[6] Die Zulassung innerhalb der EU erfolgte im Juli 2021.[2][11]
Frühe Nutzenbewertung
Der Gemeinsame Bundesausschuss (G-BA) attestiert dem Wirkstoff Setmelanotid (für POMC- und PEPR-Mangel) im Rahmen der frühen Nutzenbewertung von Arzneimitteln nach § 35a SGB V einen „Anhaltspunkt für einen nicht quantifizierbaren Zusatznutzen, weil die wissenschaftliche Datengrundlage eine Quantifizierung nicht zulässt.“[12]
Verordnungsfähigkeit
Im April 2023 wurde die Verordnungsfähigkeit von Setmelanotid (als Ausnahme im Zusammenhang mit genetisch bestätigtem, durch Funktionsverlustmutationen bedingtem biallelischem Proopiomelanocortin (POMC)-Mangel (einschließlich PCSK1) oder biallelischem Leptinrezeptor (LEPR)-Mangel, oder genetisch bestätigtem Bardet-Biedl-Syndrom bei Erwachsenen und Kindern ab 6 Jahren) seitens des G-BA beschlossen.[13]
Literatur
- Clément, K., et al.: Efficacy and safety of setmelanotide, an MC4R agonist, in individuals with severe obesity due to LEPR or POMC deficiency: single-arm, open-label, multicentre, phase 3 trials. In: The Lancet Diabetes & Endocrinology. Band 8, 2020, S. 960–970, doi:10.1016/S2213-8587(20)30364-8.
- Haws, R., et al.: Effect of setmelanotide, a melanocortin-4 receptor agonist, on obesity in Bardet-Biedl syndrome. In: Diabetes, Obesity and Metabolism. Band 2020, 2020, doi:10.1111/dom.14133.
- Kühnen, P., et al.: Proopiomelanocortin Deficiency Treated with a Melanocortin-4 Receptor Agonist. In: New England Journal of Medicine. Band 375, 2016, S. 240-6, doi:10.1056/NEJMoa1512693.
Weblinks
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Übersicht über Imcivree und warum es in der EU zugelassen ist, EPAR der EMA, abgerufen am 25. Januar 2023.
- Zusammenfassung der Merkmale des Arzneimittels, (PDF; 1,0 MB) EMA, abgerufen am 25. Januar 2023.
- New Drug Therapy Approvals 2020 Berichterstattung der FDA (englisch); abgerufen am 25. Januar 2023,
- Setmelanotid | Imcivree, Pharmazeutische Zeitung, abgerufen am 25. Januar 2023.
- FDA approves first treatment for weight management for people with certain rare genetic conditions, PM der FDA vom 27. November 2020, abgerufen am 25. Januar 2023.
- Imcivree® bei genetisch bedingter Adipositas, ifap vom 15. Juni 2022, abgerufen am 25. Januar 2023,
- Orphan designation POMC, Website der EMA, abgerufen am 25. Januar 2023.
- Orphan designation (LEPR), Website der EMA, abgerufen am 25. Januar 2023.
- Orphan designation (BBS), Website der EMA, abgerufen am 25. Januar 2023.
- Rhythm Pharmaceuticals Announces European Commission Authorization of IMCIVREE® (setmelanotide) for the Treatment of Obesity and Control of Hunger Associated with POMC, PCSK1 and LEPR Deficiency, PM Rhythm vom 23. Juli 2021, abgerufen am 25. Januar 2023.
- Gemeinsamer Bundesausschuss (G-BA), Sitzung am 1. Dezember 2022, abgerufen am 25. Januar 2023.
- Anlage II zum Abschnitt F der Arzneimittel-Richtlinie Gesetzliche Verordnungsausschlüsse in der Arzneimittelversorgung und zugelassene Ausnahmen, G-BA vom 20. April 2023, abgerufen am 27. April 2023