Serotonin-N-Acetyltransferase
Serotonin-N-Acetyltransferase (AANAT) ist das Enzym, das die Übertragung eines Essigsäure-Rests auf Serotonin katalysiert. Diese Reaktion ist der erste und geschwindigkeitsbestimmende von zwei Schritten bei der Biosynthese von Melatonin. AANAT kommt in Zweiseitentieren vor. Beim Menschen ist sie hauptsächlich in der Zirbeldrüse, im oberen Verdauungsapparat und in der Netzhaut lokalisiert. Ihre Aktivität ist indirekt vom Tageslicht abhängig.[1][2][3][4]
| Serotonin-N-Acetyltransferase | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 207 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Monomer | |
| Bezeichner | ||
| Gen-Name | AANAT | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.3.1.87, Acetyltransferase | |
| Reaktionsart | N-Acetylierung | |
| Substrat | 2-Arylethylamin + Acetyl-CoA | |
| Produkte | N-Acetyl-2-arylethylamin + CoA | |
| Vorkommen | ||
| Homologie-Familie | Aryl-CoA-Acyltransferase | |
| Übergeordnetes Taxon | Zweiseitentiere | |
Katalysierte Reaktion
CH3CO-S-CoA + 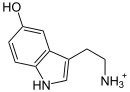 HS-CoA +
HS-CoA + 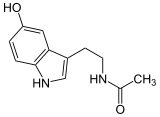
Serotonin wird zu N-Acetylserotonin umgewandelt. Auch andere 2-Arylethylamine werden als Substrat akzeptiert.
Regulation
Die Aktivität der AANAT steigt nachts auf das Zehn- bis Hundertfache. Die Zeit, um die Aktivität zu verdoppeln, liegt bei etwa 15 Minuten, und die Zeitspanne, in der sich die Aktivität morgens halbiert, liegt bei etwa 3,5 Minuten. Dieser enorme Effekt wird durch Aktivierung des Enzyms mittels Phosphorylierung und Komplexierung an 14-3-3-Proteine erreicht, die vom intrazellulären cAMP-Level abhängig ist. Dieser wiederum wird über eine Signalkaskade vom Hormon Noradrenalin reguliert, das abhängig vom Tageslicht vom Nucleus suprachiasmaticus ausgeschüttet wird.[5]
Die Produktion von AANAT ist an das Endocannabinoid-System der Zirbeldrüse gekoppelt, das zuerst 2008 in Ratten entdeckt wurde. Die nächtliche Verstärkung der AANAT-Translation wird genetisch über das Protein hnRNP Q reguliert.[6][7]
Weblinks
- Jassal/D’Eustachio/reactome.org: N-acetylation of serotonin
Einzelnachweise
- UniProt Q16613
- Konturek SJ, Konturek PC, Brzozowski T, Bubenik GA: Role of melatonin in upper gastrointestinal tract. In: J. Physiol. Pharmacol. 58 Suppl 6. Jahrgang, Dezember 2007, S. 23–52, PMID 18212399 (krakow.pl [PDF]).
- Ichihara N, Okada M, Takeda M: Characterization and purification of polymorphic arylalkylamine N-acetyltransferase from the American cockroach, Periplaneta americana. In: Insect Biochem. Mol. Biol. 32. Jahrgang, Nr. 1, Dezember 2001, S. 15–22, PMID 11719065 (elsevier.com).
- Aisien SO, Hellmund C, Walter RD: Characterization of the arylalkylamine N-acetyltransferase in Onchocerca volvulus. In: Parasitol. Res. 82. Jahrgang, Nr. 4, 1996, S. 369–71, PMID 8740555 (researchgate.net [PDF]).
- Klein DC: Arylalkylamine N-acetyltransferase: "the Timezyme". In: J. Biol. Chem. 282. Jahrgang, Nr. 7, Februar 2007, S. 4233–7, doi:10.1074/jbc.R600036200, PMID 17164235.
- Koch M, Habazettl I, Dehghani F, Korf HW: The rat pineal gland comprises an endocannabinoid system. In: J. Pineal Res. 45. Jahrgang, Nr. 4, November 2008, S. 351–60, doi:10.1111/j.1600-079X.2008.00597.x, PMID 18554250.
- Kim TD, Woo KC, Cho S, Ha DC, Jang SK, Kim KT: Rhythmic control of AANAT translation by hnRNP Q in circadian melatonin production. In: Genes Dev. 21. Jahrgang, Nr. 7, April 2007, S. 797–810, doi:10.1101/gad.1519507, PMID 17403780, PMC 1838531 (freier Volltext).