Selenige Säure
Selenige Säure ist ein wasserlöslicher kristalliner Feststoff mit der Summenformel H2SeO3. Sie ist eine zweiprotonige Säure des Selens. Ihre Salze heißen Selenite. Selenige Säure ist giftig.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
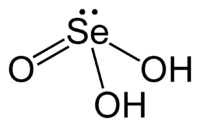 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Selenige Säure | |||||||||||||||||||||
| Andere Namen |
Dihydrogenselenit (IUPAC) | |||||||||||||||||||||
| Summenformel | H2SeO3 | |||||||||||||||||||||
| Kurzbeschreibung |
weiße, hygroskopische Kristalle[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 128,97 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Dichte |
3,004 g·cm−3[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
0,02 mg·m−3 [1] | |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Gewinnung und Darstellung
Selenige Säure kann aus der Umsetzung von Selendioxid und Wasser oder Salpetersäure mit Selen erhalten werden.[4]
Chemische Eigenschaften
Selenige Säure ist sehr gut wasserlöslich und wirkt stark hygroskopisch. In Wasser gelöst reagiert sie stark sauer (pKs-Wert der ersten Protolysestufe: 2,62 und der zweiten Protolysestufe: 8,32).[5]
Sie ist eine schwächere Säure als die Schweflige Säure, ist aber im Gegensatz zu dieser in Form von Kristallen isolierbar. Sie zeigt praktisch keine reduzierende Eigenschaften.[6] Von Schwefeldioxid, Schwefelwasserstoff, Iodwasserstoff und Hydrazin wird sie zu rotem Selen reduziert.[7]
Von Wasserstoffperoxid, Kaliumpermanganat oder Chlorsäure wird sie zu Selensäure oxidiert.[8]
Verwendung
Selenige Säure wird als Katalysator zur Synthese von 1,2-Dialdehyden verwendet.[9]
In der Industrie dient sie zur Farbveränderung von metallischen Werkstoffen. Vor allem in der Waffenindustrie ist ein "blueing" genanntes Verfahren bekannt, mit dem Stahloberflächen gefärbt werden.[10] Ähnliche Verfahren verwendet die Chemische Industrie zur Oberflächenverfärbung, beispielsweise von Kupfer.[11] In den Vereinigten Staaten gibt es Drogentests, deren Schlüsselreagenz selenige Säure ist.[12][13]
Biologische Bedeutung
Selenige Säure ist wie viele Selenverbindungen toxisch für den menschlichen Körper.[14] Nach deutschem Wasserrecht ist die Verbindung mit der Wassergefährdungsklasse 3 gekennzeichnet. Die mittlere Letale Konzentration für Fische beträgt 6,61 g·m−3. Es liegen Anzeichen für eine mögliche karzinogene Wirkung der Verbindung vor.[1] Der biologische Grenzwert beträgt 150 µg· l−1.[15]
Sicherheitshinweise
Selenige Säure wirkt auf Haut, Atemwege und Schleimhäute stark reizend. Sie ist in der Lage, in hohen Konzentrationen lebendes Gewebe zu zerstören (Verätzung). Aussetzung mit der Verbindung über einen längeren Zeitraum kann schwere physiologische Schäden verursachen. Selenige Säure ist bereits in kleinsten Mengen hoch giftig. Bei Intoxikationen mit Selenverbindungen muss mit bleibenden Schäden gerechnet werden.[1][16]
Einzelnachweise
- Eintrag zu Selenige Säure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. Oktober 2012. (JavaScript erforderlich)
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Selenverbindungen mit Ausnahme von Cadmiumsulfoselenid, soweit in diesem Anhang nicht gesondert aufgeführt im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 10. Januar 2023. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Datenblatt Selenous acid, 99.999% trace metals basis bei Sigma-Aldrich, abgerufen am 25. Oktober 2012 (PDF).
- Eintrag zu Selenious acid in der Hazardous Substances Data Bank (via PubChem), abgerufen am 25. Oktober 2012.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- M. Binnewies et alii: Allgemeine und Anorganische Chemie. 2. Auflage. Spektrum, 2011, ISBN 3-8274-2533-6, S. 567.
- Erwin Riedel, Christoph Janiak: Anorganische Chemie. 8. Auflage. de Gruyter, 2011, ISBN 3-11-022566-2, S. 458.
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 432–3.
- Anthony R. Ronzio and T. D. Waugh: Glyoxal Bisulfite In: Organic Syntheses. 24, 1944, S. 61, doi:10.15227/orgsyn.024.0061; Coll. Vol. 3, 1955, S. 438 (PDF).
- R. Angier: Firearm Blueing and Browning, Stackpole Co., Harrisburg, 1936.
- Poisons Information Monograph (PIM) für Selenium, abgerufen am 9. Dezember 2014.
- Sirchie Finger Print Laboratories, Inc. Mai 2006.
- Infoblatt des Justizministeriums der Vereinigten Staaten: Color Test Reagents/Kits forPreliminary Identificationof Drugs of Abuse (PDF; 135 kB).
- Europäische Behörde für Lebensmittelsicherheit: Selenious acid as a source of selenium added for nutritional purposes to food supplements. In: EFSA Journal. 7, 2009, doi:10.2903/j.efsa.2009.1009. (PDF)
- W. Forth, D. Henschler, W. Rummel, K. Starke: Allgemeine und spezielle Pharmakologie und Toxikologie 7. Aufl.; Spektrum Akademischer Verlag GmbH, Heidelberg 1996.
- Robert M. Russell (für die deutsche Ausgabe: Hans-Joachim F. Zunft). Vitamine und Spurenelemente – Mangel und Überschuss. In: Manfred Dietel, Joachim Dudenhausen, Norbert Suttorp (Hrsg.) Harrisons Innere Medizin, Berlin 2003, ISBN 3-936072-10-8.


