Sclareol
Sclareol ist ein natürlich vorkommender bicyclischer Diterpen-Alkohol (Terpenoid). Sclareol besitzt das Kohlenstoff-Grundgerüst des Diterpens Labdan; der bicyclische Kern besteht aus zwei anellierten Cyclohexan-Ringen. Sclareol gehört damit zur Gruppe der Labdane. Der bernsteinfarbene Feststoff weist einen süßen, balsamischen Duft auf.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
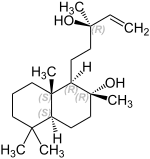 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Sclareol | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C20H36O2 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 308,50 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen
.jpg.webp)
Sclareol kommt natürlich in Gewöhnlichem Andorn (Marrubium vulgare), Muskatnuss (Myristica fragrans), Muskatellersalbei (Salvia sclarea) und Echtem Thymian (Thymus vulgaris) vor.[3]
Gewinnung und Darstellung
(-)-Isomers_13-Epimer.png.webp)
(−)-Sclareol kann durch klassische Wasserdampfdestillation aus Muskatellersalbei gewonnen werden. 2010 wurde der enzymatische Reaktionsweg zur biologischen Synthese veröffentlicht.[4] Mitunter wurde hierbei auch ein alternatives Herstellungsverfahren vorgestellt, welches die Expression von Sclareol aus genveränderten Kolibakterien beschreibt. Hierbei entsteht neben dem gewünschten (−)-Sclareol auch 13-epi-Sclareol, welches mittels Gaschromatographie entfernt werden kann.
Das (+)-Enantiomer von Sclareol kann durch Extraktion aus Conyza trihecatactis gewonnen werden.[5]
Verwendung und Eigenschaften
Sclareol wird als Duftstoff in Kosmetika und Parfüms sowie als Aromastoff in Lebensmitteln verwendet. Besonders zur alternativen Synthese von Ambrox (anstelle von Ambrein) kommt Sclareol zum Einsatz.
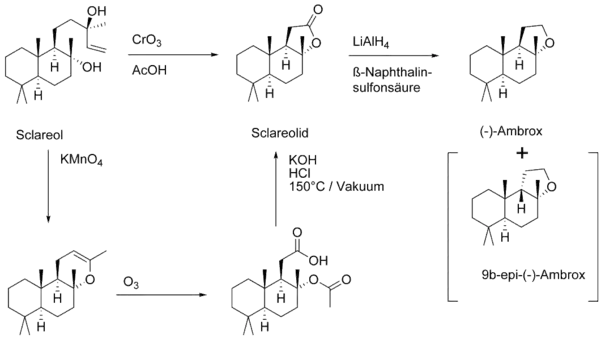
Schlüsselschritt der technischen Synthese ist der oxidative Abbau der Seitenkette durch Oxidation mit Chromtrioxid CrO3. Die anschließende Reduktion des Lactons mit Lithiumaluminiumhydrid führt zum Diol welches im Sauren zum gewünschten Ether cyclisiert. Als Nebenprodukt kann das thermodynamisch stabilere 9b-epi-Ambrox entstehen. Die Reaktion ist in großem Maßstab mit einer Ausbeute von 54 % durchführbar.[6]
Sclareol induziert bei humanen Leukämiezellen sowie Darmtumorzellen eine Apoptose. Das Auftreten des Zelltods ist zeit- und dosisabhängig.[7]
Einzelnachweise
- Eintrag zu SCLAREOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 8. Februar 2021.
- Datenblatt Sclareol bei Sigma-Aldrich, abgerufen am 6. Januar 2013 (PDF).
- SCLAREOL (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 28. November 2021.
- M. Schalk, L. Daviet: Toward a Biosynthetic Route to Sclareol and Amber Odorants; in: J. Am. Chem. Soc., 2012, 134 (46), S. 18900–18903; doi:10.1021/ja307404u.
- Torrenegra, R., Robles, J.: Diterpenes and diterpene xylosides from Conyza trihecatactis, in: Phytochemistry 1994, 35, S. 195–199.
- B. Schäfer, Chemie in unserer Zeit, 2011, 45, 374 – 388; doi:10.1002/ciuz.201100557.
- K. Dimasa, D. Kokkinopoulos: The effect of sclareol on growth and cell cycle progression of human leukemic cell lines, In: Leukemia Research, 1999, 23, 3, 217–234; doi:10.1016/S0145-2126(98)00134-9.