Sandmeyer-Reaktion
Durch eine Sandmeyer-Reaktion, benannt nach deren Entdecker Traugott Sandmeyer (1854–1922), wird mittels einer Diazotierung die Aminogruppe einer aromatischen Verbindung durch ein Nukleophil substituiert. Die Reaktion eignet sich gut zur Chlorierung und Bromierung von Aromaten und wird dann verwendet, wenn der Substituent, wie zum Beispiel Brom, nicht durch einfaches Verkochen des Diazoniumsalzes in den aromatischen Kern eingeführt werden kann. Auch Nitrile und Arylquecksilberverbindungen können durch eine Sandmeyer-Reaktion dargestellt werden.

Zur Fluorierung ist sie schlecht geeignet, weshalb stattdessen die Schiemann-Reaktion eingesetzt wird. Die Iodierung erfolgt dagegen über eine sandmeyer-ähnliche Reaktion (siehe unten).
Die Rosenmund-von Braun-Reaktion zur Herstellung von Arylnitrilen ähnelt der Sandmeyer-Reaktion.
Reaktion
.svg.png.webp)
Das aromatische Amin wird in der Kälte mit Nitrit und dem Nukleophil (→ X) versetzt. Die Umsetzung geschieht mit Hilfe der entsprechenden Kupfer(I)-salze als Katalysatoren. Folgendes Reaktionsschema zeigt die Umsetzung des Diazoniumions mit Chlorid als Nukleophil:
.svg.png.webp)
Mechanismus
Der Mechanismus dieser Reaktion nach der Diazotierung ist noch nicht vollständig geklärt. Es wird vermutet, dass die entstehende Diazoniumverbindung unter Oxidation von ein- zu zweiwertigem Kupfer reduziert wird (SET = "single electron transfer"). Unter Abspaltung von N2 bildet sich ein Aryl-Radikal, das sich mit dem Anion (Cl−, Br−, CN−) des Kupfersalzes als Nukleophil verbindet. Dabei wird das Cu(II) über einen weiteren Einelektronentransfer wieder zu Cu(I) reduziert, es handelt sich also um einen echten Katalysator.[1]
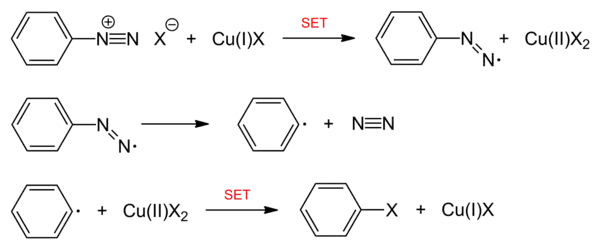
Durch die Bildung von Biphenyl als Nebenprodukt aus einer Dimerisierung wird ein radikalischer Reaktionsmechanismus plausibel. Weitere Nebenprodukte können auch Phenole, Diaryle und Azoverbindungen sein. Das Kupferion dient nur als Elektronenakzeptor bzw. -donator. Alternative Darstellungen des Mechanismus gehen jedoch von einer Bindung des Kupfer(II)-salzes an das Arylradikal und anschließendem Halogenidtransfer vom Kupfer aus.
Sandmeyer-analoge Reaktion
Auch wenn diese Reaktion nicht zu den Sandmeyer-Reaktionen zählt, bilden Aryldiazoniumsalze mit Natriumnitrit auf analoge Weise Nitroaromaten. Das Kupfer(I)-salz wird dabei jedoch in situ durch eine Redoxreaktion mit Natriumnitrit aus einem Kupfer(II)-salz gebildet. Das Nitrit dient somit sowohl als Nukleophil als auch als Reduktionsmittel.
Sandmeyer-ähnliche Reaktion
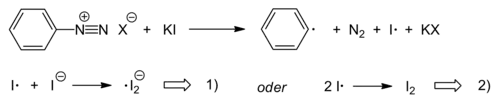
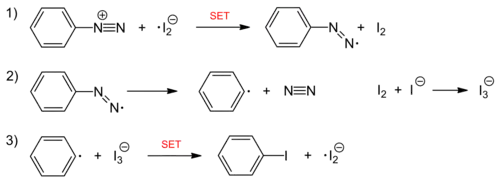
Die Iodierung von Aromaten ist durch Reaktion von Aryldiazoniumsalzen mit Kaliumiodid ebenfalls möglich. Dabei übernehmen das Nukleophil Iodid selbst und die entstehenden Iod-Spezies die Funktion des ansonsten eingesetzten Kupfer(I)-Katalysators. Bei der Reaktion handelt es sich um eine radikalische Kettenreaktion, deren Kettenträger ein Iod-Radikalanion ist. Initiiert wird die Reaktion mit der Reduktion des Diazoniumions durch Iodid.
Startreaktion:
Kettenreaktion:
Einzelnachweise
- Thomas Laue, Andreas Plagens: Namen- und Schlagwortreaktionen der Organischen Chemie. Vieweg+Teubner, Wiesbaden 2009, ISBN 978-3-8351-0091-6.
Weblinks
- Portal für organische Chemie Weitere Informationen zur Sandmeyer-Reaktion
- Sandmeyer-Reaktion – Wer steht dahinter? (Memento vom 10. März 2007 im Internet Archive)