Nolinoideae
Die Nolinoideae bilden eine Unterfamilie in der Pflanzenfamilie Spargelgewächse (Asparagaceae) innerhalb der Ordnung der Spargelartigen (Asparagales).[1][2] Viele Arten und ihre Sorten aus einigen Gattungen werden als Zierpflanzen in Parks, Gärten und Innenräumen genutzt.
| Nolinoideae | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Stechender Mäusedorn (Ruscus aculeatus) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Nolinoideae | ||||||||||||
| Burnett |
Beschreibung
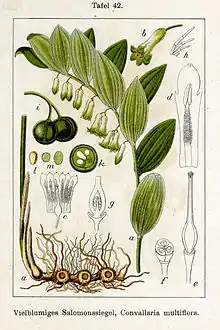







Da der Umfang der Unterfamilie Nolinoideae besonders durch molekulargenetische Eigenschaften festgelegt wurde, ist besonders die Bandbreite des Habitus der Taxa groß.
Habitus und Laubblätter
Es sind entweder verholzende Sträucher, Halbsträucher, Lianen, baumförmige Pflanzen oder mehrjährige bis ausdauernde krautige Pflanzen. Da es bei Nolinoideae kein sekundäres Dickenwachstum gibt, spricht man bei den verholzenden Arten nicht von Bäumen, sondern von baumförmigen Pflanzen. Viele Arten bilden Rhizome, manche Knollen als Überdauerungsorgane.
Die Laubblätter sind wechsel- oder gegenständig und spiralig oder zweizeilig oder quirlig angeordnet. Die Laubblätter sind einfach, ganzrandig, mit Parallelnervatur. Bei einigen Taxa sind die Blätter schuppenförmig reduziert und abgeflachte und zugespitzte Sprossachsen (Phyllokladien) ersetzt in der Aufgabe als Assimilationsorgane.
Blütenstände und Blüten
Die Blüten stehen einzeln oder zu mehreren bis vielen in traubigen Blütenständen zusammen. Bei der Gattung Ruscus sind die Blüten in traubigen Gruppen auf der Oberfläche der Phyllokladien angeordnet. Bei der Gattung Semele sind die Blüten in doldigen Gruppen am Rand der Phyllokladien angeordnet. Die meist zwittrigen oder seltener eingeschlechtigen Blüten sind radiärsymmetrisch und dreizählig. Wenn die Blüten eingeschlechtig sind dann können die Pflanzen einhäusig (monözisch) oder zweihäusig (diözisch) getrenntgeschlechtig sein. Die meist sechs Blütenhüllblätter sind meist gleichgestaltig; sie können frei oder verwachsen sein. Es sind ein oder zwei Kreise mit meist je drei (selten mit je zwei oder vier) fertilen Staubblättern vorhanden. Drei Fruchtblätter sind zu einem meist oberständigen Fruchtknoten verwachsen mit einem Griffel.
Früchte und Samen
Als Früchte werden meist bei Reife leuchtend rote oder blaue, ein- bis viersamige Beeren, seltener eine dreifächerige Kapselfrucht gebildet.
Chromosomen und Inhaltsstoffe
Die Arten haben 0,5 bis 19 µm lange Chromosomen und besitzen Chromosomengrundzahlen von x = 5–7, 9, 18–21.
An Inhaltsstoffen werden Flavonoide, Saponine und Styloidkristalle genannt.
Systematik, botanische Geschichte und Verbreitung
Gattungen und ihre Verbreitung
Mit ihrem weit gefassten Umfang hat die Unterfamilie Nolinoideae eine weite Verbreitung. Es gibt Taxa in der Holarktis, Paläotropis und der Capensis. Es gibt Vorkommen in den gemäßigten Gebieten Eurasiens und Nordamerikas, vom Mittelmeergebiet bis Kleinasien, auf den Kanaren, im südlichen Afrika, subtropischen bis tropischen Zentralamerika, und im nördlichen Australien.
Zur Unterfamilie Nolinoideae (früher Familie Ruscaceae s. l.) zählen 24 bis 30 Gattungen mit 475 bis 700 Arten:[3][4]
- Schusterpalmen (Aspidistra Ker Gawl., Syn.: Antherolophus Gagnep., Colania Gagnep., Evrardiella Gagnep., Macrogyne Link & Otto, Plectogyne Link, Porpax Salisb. nom. illeg.): Die seit 2019 etwa 160 Arten[5][6] sind in Asien vom östlichen Himalaya, Indien über China und Indochina bis Japan weitverbreitet.[4]
- Beaucarnea Lem. (Syn.: Calibanus Rose): Die seit 2016 etwa 13 Arten sind von Mexiko bis Zentralamerika verbreitet.[4][7][8]
- Chrysodracon (Jankalski) P.-L. Lu & Morden: Alle auf den Hawaii-Inseln vorkommenden sechs bis zehn Arten der Gattung Pleomele wurden 2014 in diese neue Gattung gestellt.[9] Diese Arten gehörten vor 2014 bei manchen Autoren auch zur Gattung Dracaena.
- Comospermum Rauschert: Sie enthält nur eine Art:[4]
- Comospermum yedoense (Maxim. ex Franch. & Sav.) Rauschert (Syn.: Comospermum platypetalum (Masam.) Rauschert): Sie kommt nur auf den japanischen Inseln Honshū (nur auf der Kii-Halbinsel), Shikoku sowie Kyushu vor.[4]
- Convallaria L.: Die nur etwa drei Arten gedeihen in den gemäßigten Gebieten der Nordhalbkugel.[4]
- Danae Medik. (Syn.: Danaida Rchb., Danaidia Link): Sie enthält nur eine Art:[4]
- Traubendorn (Danae racemosa (L.) Moench): Sie kommt in Westasien von der südlichen Türkei üb er das nordwestliche Syrien sowie den südöstlichen Transkaukasus bis zum nördlichen Iran vor.[4]
- Dasylirion Zucc.: Die etwa 20 Arten kommen von den südwestlichen USA bis Mexiko vor.[4]
- Disporopsis Hance (Syn.: Aulisconema Hua): Die seit 2015 etwa zehn Arten sind in Ost- sowie Südostasien vom südlichen China über Indochina bis zu den nördlichen Philippinen verbreitet.[4][10]
- Drachenbäume (Dracaena Vand. ex L., Syn.: Acyntha Medik., Draco Crantz nom. illeg., Drakaina Raf., Nemampsis Raf., Oedera Crantz nom. illeg., Pleomele Salisb., Salmia Cav., Stoerkia Crantz, Terminalis Medik.):[9] Die etwa 113 Arten gedeihen von den Subtropen bis Tropen der Alten und Neuen Welt;[4] meist im tropischen Afrika und Asien.
- Eriospermum Jacq. ex Willd. (Syn.: Loncodilis Raf., Phylloglottis Salisb., Thaumaza Salisb.):[4] Sie enthält etwa 115 Arten vom tropischen bis ins südliche Afrika.[4]
- Heteropolygonatum M.N.Tamura & Ogisu: Die seit 2017 etwa zehn Arten kommen vom südwestlichen sowie südlichen China über Thailand bis ins nördliche Vietnam vor.[4][10]
- Liriope Lour.: Die etwa sechs Arten sind von China sowie von Vietnam bis Japan und die nördlichen Philippinen verbreitet.
- Schattenblumen (Maianthemum F.H.Wigg.): Die etwa 39 Arten sind in den gemäßigten Gebieten der Nordhalbkugel verbreitet und reichen bis Zentralamerika.[4]
- Nolina Michx. (Syn.: Pincenectia K.Koch & Fintelm., Roulinia Brongn.): Die seit 2013 etwa 27 Arten kommen von den südlichen USA bis Mexiko vor.[4]
- Schlangenbart (Ophiopogon Ker Gawl. nom. cons., Syn.: Chloopsis Blume, Flueggea Rich. nom. illeg., Mondo Adans. nom. rej., Slateria Desv.): Die etwa 68 Arten kommen vom Himalaja bis Japan und Malesien, vorwiegend in Ostasien vor.[11][4]
- Peliosanthes Andrews: Die etwa 16 Arten sind überwiegend in Südostasien verbreitet.
- Weißwurzen (Polygonatum Mill.): Die etwa 75 Arten sind in den gemäßigten Gebieten der Nordhalbkugel, mit Zentren der Artenvielfalt im östlichen Himalaja und in der Indo-Burma-Region, besonders in Südwestchina verbreitet.[10][12]
- Reineckea Kunth: Sie enthält nur eine Art:[4]
- Reineckea carnea (Andrews) Kunth: Sie ist in China und Japan verbreitet.[4]
- Rohdea Roth (Titragyne Salisb. nom. superfl., Tilcusta Raf., Campylandra Baker, Gonioscypha Baker): Sie enthält seit 2010 etwa 17 Arten vom östlichen Himalaja bis Japan und Indochina.[13]
- Mäusedorn (Ruscus L.): Die etwa sieben Arten kommen in Makaronesien, Westeuropa und vom Mittelmeerraum bis zum Iran vor.
- Bogenhanf (Sansevieria Thunb.):[9][14] Die 66 bis 73[14] Arten sind von Afrika über Madagaskar und von der Arabischen Halbinsel bis Südasien weitverbreitet.
- Semele Kunth: Die etwa drei Arten kommen in Makaronesien vor,[4] darunter:
- Semele androgyna (L.) Kunth: Die zwei Unterarten kommen in Makaronesien vor.
- Speirantha Baker: Sie enthält nur eine Art:[4]
- Theropogon Maxim.: Sie enthält nur eine Art:
- Theropogon pallidus (Wall. ex Kunth) Maxim.: Sie kommt im Himalaja und China vor.
- Tupistra Ker Gawl. (Syn.: Macrostigma Kunth, Platymetra Noronha ex Salisb., Tricalistra Ridl.): Die etwa 14 Arten sind in Asien verbreitet.
Botanische Geschichte
Die Familie der Ruscaceae wurde 1826 von Kurt Sprengel in Syst. Veg., 3, 3 (Ruscinae, nom. cons.) aufgestellt. Früher bestand die Familie der Ruscaceae (s. str.) nur aus den drei Gattungen: Ruscus, Semele und Danae mit nur etwa neun Arten. Dann wurden die Taxa der ehemaligen Familien wie Aspidistraceae Hassk., Maiglöckchengewächse (Convallariaceae Horan.), Drachenbaumgewächse (Dracaenaceae Salisb., nom. cons.), Eriospermaceae Lem., Nolinaceae Nakai, Ophiopogonaceae Meisn., Platymetraceae Salisb., Polygonataceae Salisb. und Sansevieriaceae Nakai[3] in diese Familie aufgrund molekulargenetischer Untersuchungen integriert. Früher wurden einige Gattungen dieser Familie zur Familie der Liliengewächse (Liliaceae) gestellt. Rudall et al. 2000[15] stellten fest, dass der Name Ruscaceae, der von Sprengel 1826 veröffentlicht wurde Priorität hat vor Convallariaceae, die erst 1834 von Pawel Fjodorowitsch Gorjaninow veröffentlicht wurde, obwohl eigentlich die Convallariaceae um die zusätzlichen Taxa erweitert wurde (nach den Regeln des Internationalen Code der Botanischen Nomenklatur = ICBN = International Code for Botanical Nomenclature). Denn nach molekulargenetischen Untersuchungen (beispielsweise rbcL-Untersuchungen von Chase et al. 1995) waren die Convallariaceae s. str. ohne die Taxa der ehemaligen Familien Nolinaceae, Dracaenaceae und Ruscaceae paraphyletisch.
Molekulargenetische Untersuchungen haben seit den 1990er Jahren dazu geführt, dass die Familiengrenzen innerhalb der Ordnung der Spargelartigen (Asparagales) sich stark verschoben haben. So sind seit Chase et al. 2009 die Nolinoideae nur mehr eine Unterfamilie in der Familie der Spargelgewächse (Asparagaceae). Zuvor war es eine eigenständige Familie Mäusedorngewächse (Ruscaceae). Der Umfang einiger Gattungen wurde durch Neubearbeitungen im 21. Jahrhundert stark verändert. Der Name Nolinoideae hat vor Ruscoideae Priorität.[16] Die Nolinoideae wurden im Juni 1835 durch Gilbert Thomas Burnett unter dem Namen „Nolanidae“ in Outlines of Botany 985, 1095, 1106 erstveröffentlicht,[17] Typusgattung ist Nolina Michx.[18] dagegen die Ruscoideae unter dem Namen „Rusceae“ durch Leopold Dippel in Handbuch der Laubholzkunde…, 1, S. 9 erst im August–September 1889.[19]
2010 zeigten Kim et al. die Verwandtschaftsverhältnisse nach molekulargenetischen Untersuchungen.[20] Phylogenetische Untersuchungen ergaben im Jahr 2010 folgende Verwandtschaftsverhältnisse der Tribus:[20]
| Ruscaceae s. l. |
| ||||||||||||||||||||||||||||||
Spätere Untersuchungen, die weitere Gene und mehr Taxa untersuchten, haben die Gliederung der Ruscaceae s. l. in dieser Form nicht immer bestätigt,[21] die Verwandtschaftsverhältnisse waren insgesamt schlecht abgesichert und bezüglich vieler Parameter instabil. Die Gliederung der Unterfamilie in Triben sollte also als eher vorläufig betrachtet werden. Schwestergruppe der Nolinoideae ist nach allen Ergebnissen die artenarme Unterfamilie Asparagoideae. Die Möglichkeit, dass die Gattung Eriospermum basaler steht als die Asparagoideae, was die Nolinoideae paraphyletisch machen würde, konnte aber nicht ganz ausgeräumt werden.
Nutzung
Medizinisch genutzt wird vor allem der Stechende Mäusedorn (Ruscus aculeatus), dabei ist die Droge das Rhizom (Rusci rhizoma).[22] Auch der Japanische Schlangenbart (Ophiopogon japonicus) wird medizinisch genutzt.[23] Die unterirdischen Pflanzenteile einiger Liriope-Arten werden gegessen.[24] Polygonatum-Arten werden vielseitig genutzt.[25] Pflanzenteile von wenigen Maianthemum-Arten werden gegessen.[26]
Viele Arten und ihre Sorten aus einigen Gattungen werden als Zierpflanzen in Parks, Gärten und Räumen genutzt.
Quellen
- Joo-Hwan Kim, Dong-Kap Kim, Felix Forest, Michael F. Fay, Mark W. Chase: Molecular phylogenetics of Ruscaceae sensu lato and related families (Asparagales) based on plastid and nuclear DNA sequences. In: Annals of Botany. Volume 106, 2010, S. 775–790. doi:10.1093/aob/mcq167, PDF.
- Die Unterfamilie Nolinoideae innerhalb der Familie der Asparagaceae s.l. bei der APWebsite. (Abschnitte Beschreibung und Systematik)
- Paula J. Rudall, John G. Conran, Mark W. Chase: Systematics of Ruscaceae/Convallariaceae: a combined morphological and molecular investigation. In: Botanical Journal of the Linnean Society. Band 134, Nummer 1–2, 2000, S. 73–92, DOI:10.1111/j.1095-8339.2000.tb02346.x.
- Die Familie der Ruscaceae s.str. mit nur drei Gattungen bei DELTA von L. Watson & M. J. Dallwitz. (engl.)
- Joachim Thiede: Nomenclatural status of unranked names published by Trelease (1911) in Beaucarnea, Dasylirion, and Nolina (Asparagaceae-Nolinoideae). In: Phytoneuron, Volume 77, Issue 1–4, 2012. ISSN 2153-733X PDF.
Weiterführende Literatur
- Zhong-Shuai Sun, Peng-He Cao, Yue-Ling Li, Sheng Huang: Complete chloroplast genome of Reineckia carnea and its implications for the phylogenetic position within Nolinoideae (Asparagaceae). In: Mitochondrial DNA Part B, Resources, Volume 4, Issue 2, 10. Juli 2019, S. 2129–2130. doi:10.1080/23802359.2019.1623119
- Xiao-Juan Zhang: The applications of Reineckea carnea in horticulture and pharmacy. In: Hubei Agricultural Sciences, Volume 48, 2009, S. 662–663.
Einzelnachweise
- The Angiosperm Phylogeny Group: An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG III. In: Botanical Journal of the Linnean Society. Volume 161, Issue 2, 2009, S. 105–121, doi:10.1111/j.1095-8339.2009.00996.x (englisch).
- The Angiosperm Phylogeny Group: An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG IV. In: Botanical Journal of the Linnean Society. Volume 181, Issue 1, 2016, S. 1–20, doi:10.1111/boj.12385.
- Nolinoideae im Germplasm Resources Information Network (GRIN), USDA, ARS, National Genetic Resources Program. National Germplasm Resources Laboratory, Beltsville, Maryland.
- Asparagaceae. In: POWO = Plants of the World Online von Board of Trustees of the Royal Botanic Gardens, Kew: Kew Science, abgerufen am 28. Februar 2020..
- Nikolay A. Vislobokov, Maxim S. Nuraliev, Andrey N. Kuznetsov, Svetlana P. Kuznetsova: Aspidistra globosa (Asparagaceae, Nolinoideae), a new species with erect stem from southern Vietnam. In: Phytotaxa, Volume 282, Issue 1, Oktober 2016, S. 46. doi:10.11646/phytotaxa.282.1.5 Volltext-PDF.
- Nikolay A. Vislobokov, Andrey N. Kuznetsov, Svetlana P. Kuznetsova, Evgeniya Kuzmicheva: Aspidistra corniculata (Asparagaceae, Nolinoideae), a new species from Vietnam. In: Phytotaxa, Volume 397, Issue 1, 14. März 2019, S. 125–128. doi:10.11646/phytotaxa.397.1.15
- Fritz Hochstätter: Beaucarnea Lem., Nolina Michx., Dasylirion Zucc. (Nolinaceae). 2016. ISSN 2364-5210. PDF. (Memento des vom 16. September 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Vanessa Rojas-Piña, Mark E. Olson, Leonardo O. Alvarado-Cárdenas, Luís Enrique Eguiarte: Molecular phylogenetics and morphology of Beaucarnea (Ruscaceae) as distinct from Nolina, and the submersion of Calibanus into Beaucarnea. In: Taxon, Volume 63, Issue 6, 2014, S. 1193–1211. doi:10.12705/636.31
- Pei-Luen Lu, Clifford W. Morden: Phylogenetic Relationships among Dracaenoid Genera (Asparagaceae: Nolinoideae) Inferred from Chloroplast DNA Loci. In: Systematic Botany, Volume 39, Issue 1, 2014, S. 90–104, doi:10.1600/036364414X678035.
- Ying Meng, Ze-Long Nie, Tao Deng, Jun Wen, Yong-Ping Yang: Phylogenetics and evolution of phyllotaxy in the Solomon's seal genus Polygonatum (Asparagaceae: Polygonateae). In: Botanical Journal of the Linnean Society, Volume 176, Issue 4, Dezember 2014, S. 435–451. doi:10.1111/boj.12218
- Guang-Yan Wang, Ying Meng, Jin-Ling Huang, Yong-Ping Yang: Molecular Phylogeny of Ophiopogon (Asparagaceae) Inferred from Nuclear and Plastid DNA Sequences. In: Systematic Botany, Volume 39, Issue 3, Juli 2014, S. 776–784. doi:10.1600/036364414X682201
- Aaron Floden, E. E. Schilling: Using phylogenomics to reconstruct phylogenetic relationships within tribe Polygonateae (Asparagaceae), with a special focus on Polygonatum. In: Molecular Phylogenetics and Evolution. Volume 129, Dezember 2018, S. 202–213. doi:10.1016/j.ympev.2018.08.017
- N. Tanaka: A taxonomic revision of the genus Rohdea (Asparagaceae). In: Makinoa, n.s. 9, 2010, S. 1–54.
- A. S. Baldwin, R. H. Webb: The genus Sansevieria: an introduction to Molecular (DNA) analysis and preliminary insights to intrageneric relationships. In: Sansevieria, Volume 34, 2016, S. 14–26. PDF.
- Paula J. Rudall, John G. Conran, Mark W. Chase: Systematics of Ruscaceae/Convallariaceae: a combined morphological and molecular investigation. In: Botanical Journal of the Linnean Society, Volume 134, Issue 1-2, 2000, S. 73–92.
- Mark W. Chase, James L. Reveal, Michael F. Fay: A subfamilial classification for the expanded asparagalean families Amaryllidaceae, Asparagaceae and Xanthorrhoeaceae. In: Botanical Journal of the Linnean Society, Volume 161, Issue 2, 2009, S. 132–136. doi:10.1111/j.1095-8339.2009.00999.x
- Gilbert Thomas Burnett: Outlines of Botany. Band 2, London 1835, S. 985, Pkt. 4479, S. 1062., S. 1106.
- Nolinoideae bei Tropicos.org. Missouri Botanical Garden, St. Louis, abgerufen am 18. Februar 2020.
- James L. Reveal: Subfamily Names (last revised 2003).
- Joo-Hwan Kim, Dong-Kap Kim, Felix Forest, Michael F. Fay, Mark W. Chase: Molecular phylogenetics of Ruscaceae sensu lato and related families (Asparagales) based on plastid and nuclear DNA sequences. In: Annals of Botany. Volume 106, 2010, S. 775–790. doi:10.1093/aob/mcq167, PDF.
- Ole Seberg, Gitte Petersen, Jerrold I. Davis, J. Chris Pires, Dennis W. Stevenson, Mark W. Chase, Michael F. Fay, Dion S. Devey, Tina Jørgensen, Kenneth J. Sytsma, Yohan Pillon: Phylogeny of the Asparagales based on three Plastid and two mitochondrial genes. In: American Journal of Botany, Volume 99, Issue 5, 2012, S. 875–889. doi:10.3732/ajb.1100468
- Ruscus aculeatus bei Plants for A Future. (engl.)
- Ophiopogon japonicus bei Plants for A Future. (engl.)
- Liriope+graminifolia, Liriope minor, Liriope muscari, Liriope spicata bei Plants for A Future. (engl.)
- Polygonatum bei Plants For A Future, abgerufen am 30. September 2012.
- Maianthemum canadense und Maianthemum dilatatum bei Plants for A Future. (engl.)
