Retinylpalmitat
Retinylpalmitat auch Vitamin-A-Palmitat oder Retinolpalmitat genannt ist der Carbonsäureester, der durch Veresterung von Retinol (Vitamin A) mit Palmitinsäure entsteht.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
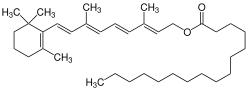 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | [(2E,4E,6E,8E)-3,7-Dimethyl-9-(2,6,6-trimethylcyclohex-1-en-1-yl)nona-2,4,6,8-tetraenyl] hexadecanoat | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C36H60O2 | ||||||||||||||||||
| Kurzbeschreibung |
viskos, teilweise gelblich kristallin, milder Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 524,86 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig oder fest[2] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Verwendung
Retinylpalmitat wird oft durch seine synthetische Alternative Retinylacetat in Vitamin A-Präparaten ersetzt und ist in öliger oder trockener Form erhältlich. Es ist ein gängiges Vitaminpräparat, das sowohl in oraler als auch in injizierbarer Form zur Behandlung von Vitamin-A-Mangel erhältlich ist. Es wird unter folgenden Produktnamen angeboten:
- Aquasol A
- Palmitate A
Ebenfalls ist es Bestandteil der intraokularen Behandlung trockener Augen in einer Konzentration von ca. 138 μg / g (z. B. VitA-Pos) durch Ursapharm. Es ist eine vorgeformte Version von Vitamin A; daher sollte die Aufnahme die empfohlene Tagesdosis (RDA) nicht überschreiten. Eine Überdosierung vorgeformter Vitamin A-Formen wie Retinylpalmitat führt zu nachteiligen physiologischen Reaktionen (Hypervitaminose A).[4]
Retinylpalmitat wird auch als Antioxidans und als Vitamin A-Quelle für fettarme Milch und andere Milchprodukte verwendet, um den durch die Entfernung von Milchfett verlorenen Vitamingehalt zu ersetzen.[5]
Retinylpalmitat ist auch Bestandteil einiger typischer Hautpflegeprodukte. Nach seiner Aufnahme in die Haut wird Retinylpalmitat in Retinol und anschließend in Retinsäure (die in Retin-A enthaltene aktive Form von Vitamin A) umgewandelt, obwohl weder seine Hautabsorption[6] noch seine Umwandlung sehr effektiv ist.[7]
Schwangerschaft
Die Empfehlung der Weltgesundheitsorganisation (WHO) zur Nahrungsergänzung mit vorgeformtem Vitamin A (Retinylpalmitat oder Retinylacetat) von Müttern während der Schwangerschaft besagt, dass "gesundheitliche Vorteile für die Mutter und ihren sich entwickelnden Fötus entstehen bei einem gleichzeitigen geringen Risiko einer Beeinträchtigung, solange eine tägliche Nahrungsergänzung von nicht mehr als 10.000 IE vorgeformtem Vitamin A (3000 μg Retinol) eingenommen wird. "[8]
Kontroverse um Karzinogenität
Der New Yorker Senator Chuck Schumer hat geäußert, dass hohe Dosen von Retinylpalmitat nachweislich im Tierversuch Krebs auslösen können.[9] Die Kontroverse um Retinylpalmitat-haltige Sonnenschutzmittel wurde so befeuert.[10] Eine toxikologische Analyse ergab, dass „es keine überzeugenden Beweise gibt, die die Annahme stützen, dass [Retinylpalmitat] in Sonnenschutzmitteln krebserregend ist“.[10] Ein später vom National Toxicology Program herausgegebener technischer Bericht kam zu dem Schluss, dass Diisopropyladipat die Inzidenz von Hauttumoren bei Mäusen erhöht und die Zugabe von entweder Retinsäure oder Retinylpalmitat verschlimmerte sowohl die Rate als auch die Häufigkeit von Tumoren.[11]
Vorkommen in der Natur
Das Retinylpalmitat kommt hauptsächlich in fetten Meeresfischen z. B. in Dorschen und Heilbutt, in Säugetierleber, in Milch, Butter und Eigelb, im Körperfett vieler Tiere sowie in Form als Provitamine (Carotinoide) in Pflanzen vor.[12]
Siehe auch
Einzelnachweise
- Eintrag zu RETINYL PALMITATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. Januar 2021.
- Eintrag zu all-trans-Retinylpalmitat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- J. J. Kamm: Toxicology, carcinogenicity, and teratogenicity of some orally administered retinoids. In: Journal of the American Academy of Dermatology. Band 6, Nummer 4 Pt 2 Suppl, April 1982, S. 652–659, doi:10.1016/s0190-9622(82)70054-4, PMID 7040511 (Review).
- Vitamin A, Linus Pauling Institute.
- Peter Nuhn: Naturstoffchemie, S. Hirzel Wissenschaftliche Verlagsgesellschaft, Stuttgart, 2. Auflage, 1990, ISBN 3-7776-0473-9, S. 339–341.
- E. A. Duell, S. Kang & J. J. Voorhees: Unoccluded retinol penetrates human skin in vivo more effectively than unoccluded retinyl palmitate or retinoic acid. In: Journal of Investigative Dermatology. Band 109, Nr. 3, 1997, S. 301–305, doi:10.1111/1523-1747.ep12335788, PMID 9284094.
- J. Boehnlein, A. Sakr, J. L. Lichtin, R. L. Bronaugh: Characterization of Esterase and Alcohol Dehydrogenase Activity in Skin. Metabolism of Retinyl Palmitate to Retinol (Vitamin A) During Percutaneous Absorption. Band 11, Nr. 8. Pharmaceutical Research, 1994, S. 1155–1159, doi:10.1023/A:1018941016563.
- Safe vitamin A dosage during pregnancy and lactation. WHO, abgerufen am 1. April 2020 (englisch).
- Possible link between ingredient in sunscreen and skin cancer: Schumer In: New York Daily News, 14. Juni 2010 (englisch).
- SQ. Wang, SW. Dusza, HW. Lim: Safety of retinyl palmitate in sunscreens: a critical analysis. In: Journal of the American Academy of Dermatology. Band 63, Nr. 5, 2010, S. 903–6, doi:10.1016/j.jaad.2010.07.015, PMID 20692724.
- NTP technical report on the photocarcinogenesis study of retinoic acid and retinyl palmitate [CAS Nos. 302-79-4 (All-trans-retinoic acid) and 79-81-2 (All-trans-retinyl palmitate)] in SKH-1 mice (Simulated solar light and topical application study). National Toxicology Program, abgerufen am 1. April 2020 (englisch).
- G. Habermehl, P.E. Hammann, H.C. Krebs, W. Ternes: Naturstoffchemie Eine Einführung. 3. Auflage. Band 1. Springer-Verlag, Heidelberg 2008, ISBN 978-3-540-73732-2, S. 660.
