Repaglinid
Repaglinid ist ein kurzwirksames orales Antidiabetikum aus der Gruppe der Glinide zur Behandlung des Typ-2-Diabetes. Repaglinid wurde 1983 entwickelt und ist seit 1998 unter dem Handelsnamen NovoNorm in Deutschland zugelassen. Seit dem 18. Februar 2016 können Glinide in Deutschland nur noch in medizinisch begründeten Einzelfällen von der GKV erstattet werden, da ihr Nutzen nicht ausreichend durch Studien belegt ist.[4] In der Nationalen VersorgungsLeitlinie (NVL) Typ-2-Diabetes aus dem Jahr 2021[5] ist der Wirkstoff nicht mehr aufgeführt, er wird aber nach wie vor von Diabetologen verschrieben und darf bei einer glomerulären Filtrationsrate > 25 ml/min eingesetzt werden.[6]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
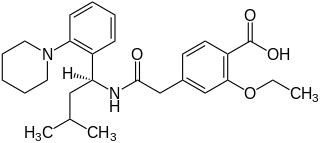 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Repaglinid | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C27H36N2O4 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
A10BX02 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
Kaliumkanal-Blocker | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 452,59 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Pharmakologische Eigenschaften
Repaglinid wirkt durch eine Blockade ATP-sensitiver Kaliumkanäle an den β-Zellen der Bauchspeicheldrüse. Durch diese Blockade kommt es zur Membrandepolarisation und damit zur Öffnung spannungsabhängiger Calciumkanäle, wodurch Calciumionen in das Zellinnere strömen. Dadurch verschmelzen verstärkt Insulin-haltige Bläschen mit der Zellmembran (Exozytose), es kommt zu einer verstärkten Insulinfreisetzung. Aufgrund dieses Wirkmechanismus zählen die Glinide zu den insulinotropen Antidiabetika.[7]
Repaglinid wird nach oraler Aufnahme schnell resorbiert. Der maximale Plasmaspiegel wird innerhalb von etwa einer Stunde erreicht, weshalb der Wirkstoff kurz vor den Hauptmahlzeiten eingenommen werden soll. Die gleichzeitige Einnahme mit der Nahrung verringert die Bioverfügbarkeit. Sie beträgt 60 bis 75 %. Der Wirkstoff wird durch das Cytochrom P450-Enzymsystem, speziell vor allem durch CYP2C8 und CYP3A4 abgebaut.[8] Die Ausscheidung der Metaboliten erfolgt vorwiegend über die Galle und letztlich den Stuhl.[7][9] Die Halbwertzeit des Wirkstoffs beträgt eine Stunde.[10]
Nebenwirkungen
Die häufigsten Nebenwirkungen sind Unterzuckerung, Bauchschmerzen und Durchfall.[10]
Kontraindikationen
Da der Wirkstoff nur die körpereigene Insulinfreisetzung fördert, ist er beim Typ-1-Diabetes nicht angezeigt. Die gleichzeitige Einnahme mit anderen Gliniden oder mit den auf dem gleichen Wirkprinzip basierenden Sulfonylharnstoffen ist kontraindiziert.
Repaglinid sollte nicht zusammen mit anderen durch CYP2C8 und/oder CYP3A4 abgebauten Wirkstoffen eingesetzt werden, da diese den Abbau von Repaglinid verzögern und damit das Risiko einer Unterzuckerung stark erhöhen. Hierzu gehören beispielsweise das Antibiotikum Clarithromycin oder der Blutfettsenker Gemfibrozil. Das gegen Pilzinfektionen eingesetzte Ketoconazol interagiert zwar ebenfalls mit diesen Cytochromen, erreicht aber selten Konzentrationen, die zu einer Hemmung des Enzymsystems und zu einem Abfall des Blutzuckers führen.[8] Der Blutverdünner Clopidogrel ist ein CYP2C8-Inhibitor und führt ebenfalls zu einem starken Blutzuckerabfall bei gleichzeitiger Einnahme von Repaglinid, so dass dies eine absolute Kontraindikation darstellt.[11]
Bei diabetischer Ketoazidose oder schwerer Lebererkrankung ist der Wirkstoff ebenfalls kontraindiziert.[10]
Entwicklungsgeschichte
Repaglinid ist der erste therapeutisch eingesetzte Vertreter aus der Stoffgruppe der Glinide.[12] Die Entwicklung begann 1983 bei der Firma Dr. Karl Thomae GmbH (später in Boehringer Ingelheim aufgegangen).[13] Grundsätzliche Strukturen, Synthese und die im Tierversuch festgestellte blutzuckersenkende Wirkung wurden 1983 in einer Patentschrift offengelegt,[14] es folgten Schriften zu stereochemischen und polymorphen Formen,[13] bis 1991 die isomerenreine Verbindung, ihre Synthese und Verwendung angemeldet wurden.[15] Ab 1990 bestand eine Kooperation von Boehringer mit dem Unternehmen Novo Nordisk, die die weltweiten Vermarktungsrechte besitzt.[16] Eine 1993 publizierte offene kontrollierte Vergleichsstudie an 44 Patienten über 12 Wochen zeigte, dass Repaglinid bei der Senkung des postprandialen Blutzuckerspiegels wirksamer war als der Sulfonylharnstoff Glibenclamid.[17][18] In den USA wurde Repaglinid 1997 als Prandin zugelassen,[19] 1998 folgte unter dem Handelsnamen Novonorm die EU-Zulassung,[20] 1999 die für die Schweiz.[21] Die Markteinführung in Deutschland war im Oktober 1998.[22]
Handelsnamen
NovoNorm (EU), Prandin (US), Gluconorm (Canada), Surepost (Japan)
Weblinks
Einzelnachweise
- Datenblatt Sigma-Aldrich, >98% (HPLC), solid bei Sigma-Aldrich, abgerufen am 5. Dezember 2023 (PDF).
- European Pharmacopoeia 11.0, Monograph 2135: Repaglinide. EDQM, 2022.
- Eintrag zu Repaglinide, >98.0% bei TCI Europe, abgerufen am 5. Dezember 2023.
- Pressemitteilung des G-BA vom 18. Februar 2016, abgerufen am 13. April 2016.
- NVL Typ-2-Diabetes
- Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). Nationale VersorgungsLeitlinie Typ-2-Diabetes – Leitlinienreport, 2. Auflage. Version 1. 2021. doi:10.6101/AZQ/000476
- Aktories K., Förstermann U., Hofmann F., Starke K.: Allgemeine und Spezielle Pharmakologie und Toxikologie. 9. Auflage. Urban & Fischer Verlag/Elsevier Verlag, München/Jena 2006, ISBN 978-3-437-44490-6, S. 626–629.
- Tanja Busk Bidstrup et al.: CYP2C8 and CYP3A4 are the principal enzymes involved in the human in vitro biotransformation of the insulin secretagogue repaglinide. In: Br J Clin Pharmacol. 2003 Sep; 56(3): 305–314.
- Mutschler E., Geisslinger G., Kroemer HK., Ruth P, Schäfer-Korting M.: Arzneimittelwirkungen. Lehrbuch der Pharmakologie und Toxikologie. 9. Auflage. Wissenschaftliche Verlagsgesellschaft. Stuttgart 2008. S. 419. ISBN 3-8047-1952-X.
- Repaglinid, Gelbe Liste
- Gluconorm (repaglinide) - New Contraindication for Concomitant Use with Clopidogrel
- Greg L. Plosker, David P. Figgitt: Repaglinide. In: PharmacoEconomics. 2004, Band 22, Nummer 6, S. 389–411 doi:10.2165/00019053-200422060-00005.
- Repaglinide auf pharmaceutical-substances.thieme.com, abgerufen am 9. Dezember 2023
- Patent DE3347565.
- Patent WO9300337A1.
- B. Hellwig: Neues Therapiekonzept für Typ-II-Diabetes: Prandiale Glucoseregulation mit Repa. In: deutsche-apotheker-zeitung.de. 15. Februar 1998, abgerufen am 9. Dezember 2023.
- R. Moses: Repaglinide in combination therapy with metformin in Type 2 diabetes. In: Experimental and Clinical Endocrinology & Diabetes. 2009, Band 107, Nummer S 04, S. S136–S139 doi:10.1055/s-0029-1212169.
- Bruce H. R. Wolffenbuttel, L. Nijst, J. P. J. E. Sels, P. P. C. A. Menheere, Péter Müller, A. C. Nieuwenhuijzen Kruseman: Effects of a new oral hypoglycaemic agent, repaglinide, on metabolic control in sulphonylurea-treated patients with NIDDM. In: European Journal of Clinical Pharmacology. 1993, Band 45, Nummer 2, S. 113–116. doi:10.1007/BF00315490.
- Significant FDA Approvals in 1997. In: aafp.org. 1. Juni 1998, abgerufen am 9. Dezember 2023 (englisch).
- EU/1/98/076. In: ec.europa.eu. Abgerufen am 9. Dezember 2023.
- Zugelassene Arzneimittel (XLSX, 1006 kB, 30.11.2023). In: swissmedic.ch. Abgerufen am 9. Dezember 2023.
- Avoxa – Mediengruppe Deutscher Apotheker GmbH: Repaglinid–NovoNorm®–12–1998. In: pharmazeutische-zeitung.de. 12. März 2018, abgerufen am 9. Dezember 2023.