Reagenz nach Busch
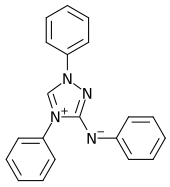
„Reagenz nach Busch“ oder genauer „Reagenz auf Salpetersäure nach Busch“ sind Trivialnamen einer Lösung einer chemischen Verbindung aus der Gruppe der Triazole, die nach ihrem Entdecker, dem Chemiker Max Busch, benannt wurde.[3][4] Ebenfalls geläufig ist die Bezeichnung Nitron, obwohl das Reagenz nicht zur Stoffgruppe der Nitrone zählt und sich von diesen strukturell erheblich unterscheidet.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Reagenz nach Busch | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C20H16N4 | |||||||||||||||
| Kurzbeschreibung |
licht und luftempfindliches gelblichgrünes Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 312,37 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
fast unlöslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Eigenschaften
Nitron (3-Anilino-1,4-diphenyl-1,2,4-triazolium, C20H16N4) liegt als gelbliches Pulver vor, bildet ein Zwitterion („Mesoion“ bzw. „Mesomeres Betain“) und ist löslich in Alkohol, Benzol und verdünnter Essigsäure unter Bildung des Acetats von Nitron. Dieses wird zum Nachweis von Nitrat-Ionen verwendet, wobei sich das Nitrat des Nitrons (C20H16N4 · HNO3) bildet, das praktisch unlöslich ist.
Verwendung
Zum Nachweis von Nitraten gibt man zu der mit verdünnter Schwefelsäure angesäuerten Probelösung unter Erwärmen Nitronacetatlösung, wobei sich ein weißlicher Niederschlag bildet. Dieses Verfahren wurde auch zum quantitativen Nachweis von Nitraten angewendet, wobei der Niederschlag nach dem Abfiltrieren und Trocknen gewogen wird (gravimetrisches Verfahren). Störend wirken dabei allerdings Nitrit-, Bromid-, Iodid-, Perchlorat- und Hexafluorophosphat-Ionen, die mit Nitron ebenfalls schwer lösliche Niederschläge bilden.[5] Aufgrund der Vielzahl möglicher Störeinflüsse – auch Chlorid kann nur in geringen Mengen toleriert werden – ist die Bestimmung mittels Nitron nur bei Abwesenheit vieler gewöhnlicher Ionen genau.[5] Eine Probenvorbehandlung, bei der störende Anionen ausgefällt, oxidiert oder reduziert werden, kann daher notwendig sein.[5] Im Falle reiner, konzentrierter Nitratlösungen ist die Bestimmung mit Nitron ziemlich genau, da über 99,5 % des Nitrats gefällt wird.[6] Die Methode ist nicht für den Mikro-Maßstab geeignet.[5]
Die Reaktion mit Hexafluorophosphat unter Bildung eines Niederschlags wurde zur gravimetrischen Bestimmung von PF6− verwendet. Das war bis 1963 die Standardmethode zur Bestimmung dieses Ions.[7]
Literatur
- Eintrag zu Nitron. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. Januar 2015.
- Gerhard-Otfried Müller: Praktikum der quantitativen chemischen Analyse, S. Hirzel Verlag Leipzig, 8. Auflage 1966, S. 353.
Einzelnachweise
- Datenblatt Nitron bei Merck, abgerufen am 22. April 2011.
- Datenblatt Nitron bei Sigma-Aldrich, abgerufen am 20. Mai 2017 (PDF).
- Max Busch: Gravimetrische Bestimmung der Salpetersäure. In: Berichte der deutschen chemischen Gesellschaft. Band 38, Nr. 1, 1. Januar 1905, S. 861–866, doi:10.1002/cber.190503801149.
- Emanuel Merck: Merck’s Reagenzien-Verzeichnis. enthaltend die gebräuchlichen Reagenzien und Reaktionen, geordnet nach Autorennamen. Dritte Auflage. Springer-Verlag, Berlin Heidelberg Februar 1913, S. 55 (eingeschränkte Vorschau in der Google-Buchsuche).
- William John Williams: Handbook of Anion Determination. Butterworth-Heinemann, London Boston Sydney u. a. 1979, ISBN 0-408-71306-2, Nitrate, S. 123–124 (eingeschränkte Vorschau in der Google-Buchsuche).
- Akiharu Hioki, Tsutomu Watanabe, Kuniko Terajima, Noriko Fudagawa, Masaaki Kubota: Accuracy in Gravimetric Determination of Nitrate and Nitrite as Nitron Nitrate. In: Analytical Sciences. Band 6, Nr. 5, 1990, S. 757–762, doi:10.2116/analsci.6.757 (jst.go.jp).
- William John Williams: Handbook of Anion Determination. Butterworth-Heinemann, London Boston Sydney u. a. 1979, ISBN 0-408-71306-2, Hexafluorophosphate, S. 428 (eingeschränkte Vorschau in der Google-Buchsuche).