Radioprotektor
Ein Radioprotektor ist ein Pharmakon, das nach seiner Verabreichung selektiv gesunde Zellen vor den toxischen Auswirkungen ionisierender Strahlung schützen soll. Durch diese Schutzfunktion kann die Strahlendosis bei einer gegen bösartige Tumoren (Krebs) gerichtete Strahlentherapie erhöht werden, um die Wirksamkeit der Strahlentherapie zu steigern. Radioprotektoren sind eine Untergruppe der Radiomodulatoren.[1]
Beschreibung
Bei der konventionellen Strahlentherapie (Radiatio) ist die niedrige Strahlungsempfindlichkeit vieler Tumoren – im Vergleich zum umgebenden gesunden Gewebe – eines der größten Probleme.[2] Um möglichst viele Tumorzellen sicher abzutöten, wäre in vielen Fällen eine deutlich höhere Strahlendosis notwendig. Dies ist aber wegen der Empfindlichkeit des umgebenden gesunden Gewebes gegen die ionisierende Strahlung meist nicht möglich. In der Strahlentherapie verfolgt man daher zwei unterschiedliche pharmakologische Ansätze, um möglichst viele Tumorzellen zu zerstören und möglichst wenige gesunde Zellen zu schädigen. Eines davon sind Radiosensitizer, die die Strahlungsempfindlichkeit der Tumorzellen erhöhen sollen. Ein anderes sind Radioprotektoren, die die gesunden Zellen vor der Strahlung schützen sollen. Durch die ionisierende Strahlung, beispielsweise Röntgen- oder Gammastrahlen, entstehen in den betroffenen Zellen hochtoxische freie Radikale, die wiederum zu reaktiven Sauerstoff- (ROS) und Stickstoffspezies (RNS) führen. Diese hochreaktiven Spezies sind im Wesentlichen für die Wirksamkeit der Strahlentherapie verantwortlich. Sie führen zu irreparablen Schäden, beispielsweise Doppelstrangbrüchen, an der DNA im Zellkern einer Zelle. Radioprotektoren sollen möglichst selektiv, das heißt nur in den gesunden Zellen, diese Schäden verhindern.
Eine Vielzahl unterschiedlicher Substanzen wurde zum Zweck der intrazellulären Radioprotektion entwickelt. Sie sollen die in den Zellen erzeugten freien Radikale abfangen, und dadurch die Elektronenentzugsrate reduzieren. Diese anti-oxidative Wirkung reduziert den Sauerstoff-Effekt. Um diese Wirkung entfalten zu können, müssen die Radioprotektoren vor der Bestrahlung verabreicht werden und im Inneren der Zellen sein. Nur so können die Moleküle der Radioprotektoren ausreichend schnell in die Bereiche diffundieren, in denen sie die passenden Reaktionspartner – freie Radikale und reaktive Sauerstoff beziehungsweise Stickstoffspezies – treffen und unschädlich machen können. Ein anderer Wirkungsmechanismus in Form eines Reparaturprozesses ist die Abgabe von Elektronen an die defekten Bindungen der DNA. Dies ist nur mit Reduktionsmitteln (Elektronendonatoren) möglich.[3]
Wirkstoffklassen
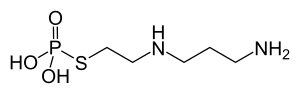

Als Radioprotektoren werden vor allem Verbindungen mit freien Thiol-Gruppen (Thiole), beziehungsweise Prodrugs, die nach Verstoffwechselung (Metabolisierung) die entsprechenden Thiole freisetzen, verwendet. Ein Beispiel für einen natürlichen Radioprotektor ist das Pseudotripeptid Glutathion, das im Zellinneren vor freien Radikalen und ROS schützt. Als von außen zugeführter Radioprotektor ist Glutathion allerdings weniger gut geeignet, da es vor dem Transport in die Zellen in seine drei Aminosäuren-Bestandteile Cystein, Glutaminsäure und Glycin zerlegt wird. Andere natürliche Radioprotektoren sind die Aminosäure Cystein (ein Bestandteil von Glutathion) und dessen Stoffwechselprodukt, das biogene Amin Cysteamin.[3]
Als Arzneimittel für die Radioprotektion explizit zugelassen ist der Wirkstoff Amifostin, ein phosphoryliertes Aminothiol.[4] Dieses Prodrug wird in den Zellen durch Alkalische Phosphatasen in den eigentlichen Wirkstoff 2-((Aminopropyl)amino)ethanthiol zerlegt. Die selektive Wirkung von Amifostin wird offensichtlich durch die höhere Aktivität der Alkalischen Phosphatasen, dem vergleichsweise höheren pH-Wert und dem günstigeren Permeationsverhalten des gesunden Gewebes verursacht. Es wird üblicherweise etwa eine halbe Stunde vor einer Radiatio als fünfzehnminütige Kurzinfusion verabreicht.[5]
Neben den Thiolen, mit dem zugelassenen Wirkstoff Amifostin, sind eine Reihe weiterer Radioprotektoren in der (prä)klinischen Entwicklung. Dazu gehören beispielsweise Radikalfänger wie beispielsweise TEMPOL (ein 4-Hydroxy-Derivat des freien Radikals 2,2,6,6-Tetramethylpiperidinyloxyl),[6] Zytokine wie Interleukin-1β,[6][7] Stammzellfaktor,[6] Enzyme wie beispielsweise Superoxiddismutase (SOD), verschiedene Vasokonstriktoren, Cimetidin,[6] Serotonin,[8] Melatonin,[9] Pyridoxin,[10] Natriumselenit[11][12] und Natriumwolframat.[13]
Die Wirksamkeit eines Radioprotektors lässt sich in Modellorganismen mit Hilfe der Elektronenspinresonanz (ESR) messen. Dabei wird die Signaldämpfung des Spin-Labels 3-Carbamoyl-PROXYL (3-Carbamoyloxy-2,2,5,5-tetramethyl-pyrrolidin-N-oxyl, CAS# 4399-80-8) gemessen. Eine Stunde nach der Bestrahlung mit Röntgenstrahlen wird das 3-Carbamoyl-PROXYL als Spinsonde verabreicht. Wurde ein Radioprotektor vor der Bestrahlung verabreicht, so wird das ESR-Signal stärker gedämpft.[6] Ein anderes, etablierteres Verfahren ist die Verwendung eines Comet-Assays.[14]
Geschichte
Die ersten Arbeiten an Radioprotektoren begannen im Rahmen des Manhattan-Projekts.[15]
Literatur
- D. Citrin, A. P. Cotrim, F. Hyodo, B. J. Baum, M. C. Krishna, J. B. Mitchell: Radioprotectors and mitigators of radiation-induced normal tissue injury. In: Oncologist Band 15, Nummer 4, 2010, S. 360–371, ISSN 1549-490X. doi:10.1634/theoncologist.2009-S104. PMID 20413641. PMC 3076305 (freier Volltext). (Review).
- S. J. Hosseinimehr: Trends in the development of radioprotective agents. In: Drug Discovery Today Band 12, Nummer 19–20, Oktober 2007, S. 794–805, ISSN 1359-6446. doi:10.1016/j.drudis.2007.07.017. PMID 17933679. (Review).
- D. M. Brizel: Pharmacologic approaches to radiation protection. In: Journal of clinical oncology Band 25, Nummer 26, September 2007, S. 4084–4089, ISSN 1527-7755. doi:10.1200/JCO.2007.11.5816. PMID 17827457. (Review).
- J. F. Fowler: Eighth annual Juan del Regato lecture. Chemical modifiers of radiosensitivity–theory and reality: a review. In: International Journal of Radiation Oncology – Biology – Physics. Band 11, Nummer 4, April 1985, ISSN 0360-3016, S. 665–674, PMID 3884559 (Review).
- T. L. Phillips: Chemical modifiers of cancer treatment. In: International journal of radiation oncology, biology, physics. Band 10, Nummer 9, September 1984, ISSN 0360-3016, S. 1791–1794, PMID 6480462.
Einzelnachweise
- B. Kaser-Hotz: Prinzipien der Strahlentherapie. In: M. Kessler (Hrsg.): Kleintieronkologie: Diagnose und Therapie von Tumorerkrankungen bei Hunden. Georg Thieme Verlag, 2005, ISBN 3-830-44103-7, S. 160. eingeschränkte Vorschau in der Google-Buchsuche.
- D. J. Lee, M. Moini, J. Giuliano, W. H. Westra: Hypoxic sensitizer and cytotoxin for head and neck cancer. In: Annals of the Academy of Medicine, Singapore. Band 25, Nummer 3, Mai 1996, S. 397–404, ISSN 0304-4602, PMID 8876907 (Review).
- H. Krieger: Grundlagen der Strahlungsphysik und des Strahlenschutzes. Ausgabe 3, Verlag Vieweg+Teubner, 2009, ISBN 3-834-80801-6, S. eingeschränkte Vorschau in der Google-Buchsuche.
- J. R. Kouvaris, V. E. Kouloulias, L. J. Vlahos: Amifostine: the first selective-target and broad-spectrum radioprotector. In: The oncologist Band 12, Nummer 6, Juni 2007, S. 738–747, ISSN 1083-7159. doi:10.1634/theoncologist.12-6-738. PMID 17602063. (Review).
- Radioprotektor als Bolus applizieren. (Memento vom 17. Oktober 2013 im Internet Archive) Praxis-Depesche 15, 1999, nach: W. Wagner, A. Radmard, G. Mansour, K. Schonekas, S. Zaknoen : Improved Feasibility of Amifostine Application in Radiotherapy by Using a New Administration Schedule (Meeting abstract). In: 1999 ASCO Annual Meeting Meeting Abstract #2348
- Y. Miura, K. Anzai, J. Ueda, T. Ozawa: Novel approach to in vivo screening for radioprotective activity in whole mice: in vivo electron spin resonance study probing the redox reaction of nitroxyl. In: Journal of radiation research Band 41, Nummer 2, Juni 2000, S. 103–111, ISSN 0449-3060. PMID 11037578.
- R. Neta, S. Douches, J. J. Oppenheim: Interleukin 1 is a radioprotector. In: Journal of Immunology (Baltimore, Md. : 1950) Band 136, Nummer 7, April 1986, S. 2483–2485, ISSN 0022-1767. PMID 3512714.
- J. R. Maisin, C. Albert, A. Henry: Reduction of short-term radiation lethality by biological response modifiers given alone or in association with other chemical protectors. In: Radiation research Band 135, Nummer 3, September 1993, S. 332–337, ISSN 0033-7587. PMID 8397428.
- A. Shirazi, G. Ghobadi, M. Ghazi-Khansari: A radiobiological review on melatonin: a novel radioprotector. In: Journal of radiation research Band 48, Nummer 4, Juli 2007, S. 263–272, ISSN 0449-3060. PMID 17641465. (Review).
- D. Thotala, S. Chetyrkin, B. Hudson, D. Hallahan, P. Voziyan, E. Yazlovitskaya: Pyridoxamine protects intestinal epithelium from ionizing radiation-induced apoptosis. In: Free radical biology & medicine Band 47, Nummer 6, September 2009, S. 779–785, ISSN 1873-4596. doi:10.1016/j.freeradbiomed.2009.06.020. PMID 19540915. PMC 2739572 (freier Volltext).
- U. M. Schleicher, C. Lopez Cotarelo, D. Andreopoulos, S. Handt, J. Ammon: Radioprotektion humaner Endothelzellen durch Natriumselenit. In: Medizinische Klinik Band 94, 1999, S. 35–38, doi:10.1007/BF03042188 PMID 10554526
- B. S. Margulies, T. A. Damron, M. J. Allen: The differential effects of the radioprotectant drugs amifostine and sodium selenite treatment in combination with radiation therapy on constituent bone cells, Ewing's sarcoma of bone tumor cells, and rhabdomyosarcoma tumor cells in vitro. In: Journal of orthopaedic research Band 26, Nummer 11, November 2008, S. 1512–1519, ISSN 1554-527X. doi:10.1002/jor.20679. PMID 18473385.
- K. Sato, M. Ichimasa, K. Miyahara, M. Shiomi, Y. Nishimura, Y. Ichimasa: Radioprotective effects of sodium tungstate on hematopoietic injury by exposure to 60Co gamma-rays in Wistar rats. In: Journal of radiation research Band 40, Nummer 2, Juni 1999, S. 101–113, ISSN 0449-3060. PMID 10494142.
- A. C. Müller: Wertigkeit des Comet Assays zur Detektion von Radioprotektion. (PDF; 1,6 MB) Dissertation, Martin-Luther-Universität Halle-Wittenberg, 2004
- C. K. Nair, D. K. Parida, T. Nomura: Radioprotectors in radiotherapy. In: Journal of radiation research. Band 42, Nummer 1, März 2001, S. 21–37, ISSN 0449-3060. PMID 11393887. (Review).