Pteridine
Als Pteridine bezeichnet man Derivate des Stammheterocyclus Pteridin. Darunter fallen biologisch wichtige Moleküle, so Folsäure und Biopterin. In den Flavinen findet man eine benzo-anellierte Pteridin-Struktur vor, z. B. in Riboflavin (Vitamin B2), Flavinmononukleotid (FMN), Flavin-Adenin-Dinukleotid (FAD).

Vorkommen

Die Pigmente der Flügel einiger Schmetterlinge (Pterine)[2][3] sowie mit hoher Wahrscheinlichkeit Farbstoffe im Gefieder von Pinguinen (Spheniscidae, Spheniscine)[4][5] enthalten ebenfalls das Pteridin-Gerüst.
Synthesen
Pteridine können aus Pyrimidinen durch Angliederung des Pyrazin-Rings oder – umgekehrt – aus Pyrazinen hergestellt werden. Eine retrosynthetische Betrachtung zeigt, dass 5,6-Diaminopyrimidine (siehe linke Formel; korrekte Bezifferung: 4,5-Diaminopyrimidine) logische Vorstufen sind. Die meisten Pteridinsynthesen folgen diesem Prinzip, da sich die Diaminopyrimidine leicht herstellen lassen. Neben der Stammsubstanz Pteridin konnten so zahlreiche 2-, 4-, 6- und 7-substituierte Derivate erhalten werden.[6] Als erster synthetisierte Oskar Isay aus 1,2-Diphenylethandion (Benzil) und 4,5-Diaminopyrimidin 6,7-Diphenylpteridin (in der Formel für R2 = R4 = H, R6 = R7 = C6H5).[7] Heterocyclen-Chemiker nennen dieses Reaktionsprinzip deshalb Isay-Reaktion, eigentlich ist es aber nichts Anderes als die zweimalige Bildung einer „Schiffschen Base“ (Azomethin). Auch die historisch erste Synthese eines Pterins, Leukopterin, basiert auf diesem Prinzip.[8]

Das zweite Syntheseprinzip (rechte Formel) wurde bei der Synthese von 2-Amino-4-hydroxypteridin (Pterin) benutzt (R4 = OCH3, X = Cl, Y = O).[9]
Einige 4,5-Diaminopyrimidine lassen sich durch Reduktion aus 4-Amino-5-nitroso-pyrimidinen herstellen. Diese können durch Kondensation mit Ketonen in Gegenwart einer Base direkt substituierte Pteridine liefern.[10] Diese Synthese wird oft als Timmis-Reaktion bezeichnet, nach dem Entdecker.[11]
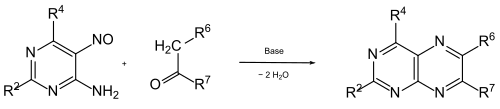
Weitere Synthesen werden bei den Pterinen und den einzelnen Verbindungen angegeben.
Literatur
- Theophil Eicher, Siegfried Hauptmann: Chemie der Heterocyclen. Struktur, Reaktionen und Synthesen. Thieme, Stuttgart 1994, ISBN 3-13-135401-1, S. 425–430.
- Theophil Eicher, Siegfried Hauptmann: The Chemistry of Heterocycles: Structure, Reactions, Syntheses, and Applications: Structure, Reactions, Synthesis, and Applications. 2. Auflage. Wiley-VCH Verlag, Weinheim 2003, ISBN 3-527-30720-6, S. 426–427.
- Wolfgang Pfleiderer: Neuere Entwicklungen in der Pteridin-Chemie. In: Angew. Chem. 75 (1963), S. 993–1014. doi:10.1002/ange.19630752102.
Einzelnachweise
- Peter Nuhn: Naturstoffchemie. S. Hirzel Wissenschaftliche Verlagsgesellschaft, Stuttgart 1990, ISBN 3-7776-0473-9, S. 361.
- Robert Purrmann: Über die Flügelpigmente der Schmetterlinge. VII. Synthese des Leukopterins und Natur des Guanopterins. In: Justus Liebigs Annalen der Chemie. 544 (1940), S. 182–190, doi:10.1002/jlac.19405440111.
- Robert Purrmann: Konstitution und Synthese des sogenannten Anhydroleukopterins. Über die Flügelpigmente der Schmetterlinge XII. In: Justus Liebigs Annalen der Chemie. 548 (1941), S. 284–292, doi:10.1002/jlac.19415480121.
- Antje Findeklee: Einzigartig gelb. Meldung bei Spektrum.de vom 20. März 2013.
- Daniel B. Thomas, Cushla M. McGoverin, Kevin J. McGraw, Helen F. James, Odile Madden: Vibrational spectroscopic analyses of unique yellow feather pigments (spheniscins) in penguins (Abstract). In: J. R. Soc. Interface. 6, 20. März 2013, Vol. 10(83), doi:10.1098/rsif.2012.1065.
- Adrien Albert, D. J. Brown, Gordon Cheeseman: Pteridine studies. Part I. Pteridine, and 2- and 4-amino- and 2- and 4-hydroxy-pteridines. In: J. Chem. Soc. 1951, S. 474–485, doi:10.1039/JR9510000474.
- O. Isay: Eine Synthese des Purins. In: Berichte der deutschen chemischen Gesellschaft. 39 (1906), S. 250–265, doi:10.1002/cber.19060390149.
- Theophil Eicher, Siegfried Hauptmann: Chemie der Heterocyclen. Struktur, Reaktionen und Synthesen. Thieme, Stuttgart 1994, ISBN 3-13-135401-1, S. 425–430.
- G. P. G. Dick, H. C. S. Wood: Pteridine derivatives. Part I. A new synthesis of 2-amino-4-hydroxypteridines. In: Journal of the Chemical Society (Resumed). 1955, S. 1379, doi:10.1039/JR9550001379.
- Theophil Eicher, Siegfried Hauptmann: Chemie der Heterocyclen. Struktur, Reaktionen und Synthesen. Thieme, Stuttgart 1994, ISBN 3-13-135401-1, S. 425–430.
- G. M. Timmis: A New Synthesis of Pteridines. In: Nature. 164 (1949), S. 139, doi:10.1038/164139a0.