Polythiophene
Polythiophene sind chemische Verbindungen aus der Gruppe der Polymere. Sie unterscheiden sich in ihren Eigenschaften nicht nur durch ihre Kettenlänge n, sondern auch durch die Substituenten R1 und R2, die im einfachsten Fall Wasserstoff, jedoch auch beliebig komplizierte Alkyl-Reste oder Alkoxyreste sein können. Im Jahre 2000 erhielten die Wissenschaftler Alan J. Heeger, Alan MacDiarmid und Hideki Shirakawa für die Entdeckung und Entwicklung leitfähiger Polymere den Nobelpreis für Chemie.
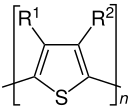
| Einige Thiophen-Derivate (links) und abgeleitete Polythiophene (rechts) | |
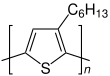
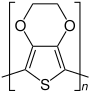
| Monomer | Polymer |
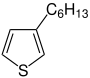 3-Hexylthiophen |
 |
 3,4-Ethylendioxythiophen |
 |
Eigenschaften

Die Polythiophene haben – unabhängig von dem jeweiligen Rest – ein über die Kette hinweg delokalisiertes π-Elektronensystem. Daraus resultiert die wichtigste gemeinsame Eigenschaft der Polythiophene: die elektrische Leitfähigkeit, weshalb Polythiophene auch als synthetische Metalle bezeichnet werden. Auch sind die Polythiophene optisch aktiv. Je nach angelegter Spannung, Lösungsmittel und Temperatur variiert die Farbe der Fluoreszenz (siehe Abbildungen).

Regioregularität
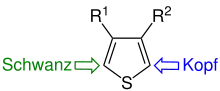
| Kopf- und Schwanzposition beim Thiophen |
|---|
 Thiophen |
Bei Bindungen zwischen einzelnen Thiophen-Molekülen (oder ihren Derivaten) gibt es drei Möglichkeiten, an welchen Atomen diese Bindungen sitzen können. Dabei wird jedem Thiophenmolekül zunächst – ähnlich wie bei der Isoprenregel – ein Kopf und ein Schwanz zugewiesen (siehe Abbildung). Daraus abgeleitet ergeben sich drei mögliche Verknüpfungen zwischen je zwei Monomeren (Kopf–Schwanz = Schwanz–Kopf):
- Kopf–Kopf
- Kopf–Schwanz
- Schwanz–Schwanz


Abgeleitet aus diesen 3 Verbindungsmöglichkeiten zwischen zwei Monomeren, ergeben sich 4 Möglichkeiten für einen Kettenverlauf (siehe nebenstehende Abbildung):
- (Kopf–Schwanz)–(Kopf–Schwanz)
- (Kopf–Kopf)–(Schwanz-Kopf)
- (Kopf–Kopf)–(Schwanz–Schwanz)
- (Schwanz–Schwanz)–(Kopf–Schwanz)
Die verschiedenen Kettenverläufe können durch eine NMR-Spektroskopie unterschieden werden und haben Auswirkungen auf die elektrische Leitfähigkeit des Polythiophens. Dabei gilt:
Je höher die Regioregularität – also je geordneter der Kettenverlauf – desto höher ist die Leitfähigkeit des Polythiophens.[1][2] So hat ein Kettenverlauf, der im 2:1 Verhältnis aus Kopf–Schwanz zu Kopf–Kopf Bindungen besteht, eine fast dreifache Leitfähigkeit gegenüber einer zufällig angeordneten Kette.[3] Des Weiteren hat die Anordnung der einzelnen Monomere auch Auswirkungen auf das Erscheinungsbild des jeweiligen Polythiophens. So bilden regioreguläre Polyalkylthiophene, die durch die Rieke-Methode synthetisiert wurden, kristalline, flexible, bronzefarbene und metallisch schimmernde Filme. Zufällig angeordnete Polyalkylthiophene hingegen bildeten amorphe und orangefarbene Filme aus.[4]
Anwendungsbeispiele
| Beispiele |
|---|
 PEDOT |
 „Fluoriertes“ Polythiophen |
 Polythiophen-Drähte |
Polythiophene lassen sich vielfältig einsetzen. In der Forschung wird laufend an verschieden substituierten Thiophenen geforscht, um bestimmte Eigenschaften zu erhalten.
PEDOT

Das in der Praxis wohl relevanteste Polythiophen ist Poly-3,4-ethylendioxythiophen (PEDOT). Es wird in der Elektrotechnik vielfältig eingesetzt, beispielsweise in der Solarzellentechnik und als Bauteil für Kondensatoren.[5][6] Besonders praktisch für die Herstellung ist, dass keine Regioregularität beachtet werden muss.
Fluoriertes Polythiophen
Ein in der Forschung und für die Praxis relevantes Polythiophen ist das „fluorierte“ Polythiophen, welches eine perfluorierte Kohlenstoffkette am Ende seines Restes enthält. Um dieses zu gewinnen, kann Thiophen über eine Grignard-Verbindung carboxyliert werden. Anschließend kann – wie im Synthese-Abschnitt erläutert – entweder eine elektrochemische oder chemische Polymerisation erfolgen.[7] Besonders interessant neben der elektrischen Leitfähigkeit ist die Stabilität von fluoriertem Polythiophen gegenüber Umwelteinflüssen, da es wasser- und ölabweisend ist.[7]
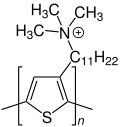
Polythiophen-Drähte
Anfang des 21. Jahrhunderts wurde eine Methode zur Synthese von kleinen Polythiophen-Drähten entwickelt. Das genaue Verfahren ist in der Literatur beschrieben.[8] Das Polythiophen, aus dem die Drähte bestehen, ist nebenstehend gezeigt. Es enthält einen Trimethylundecylammoniumrest. Als Gegenion wird das Hexafluorophosphat-Anion eingesetzt.
Herstellung
Mögliche Synthesen eines Polythiophen können auf verschiedene Arten erfolgen. Dabei kann zunächst in elektrochemische und chemische Syntheseverfahren unterteilt werden. Sowohl die elektrochemische als auch chemische Synthese hat jeweils ihre Vor- und Nachteile für verschieden substituierte Thiophene.
Elektrochemische Synthese
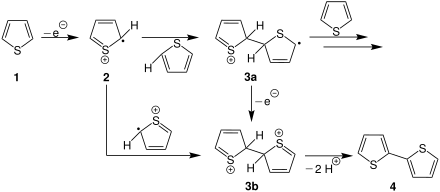
Die elektrochemische Synthese stellt eine Möglichkeit dar, Polythiophene zu synthetisieren.[9] Nebenstehend ist das Prinzip schematisch am Beispiel der Reaktion des unsubstituierten Thiophens (1) zum Dithiophen (4) dargestellt.
Im ersten Schritt wird dabei durch Oxidation ein Thiophenradikalkation 2 erzeugt. Nun sind zwei verschiedene Reaktionsverläufe denkbar:
Die erste Möglichkeit ist im oberen Verlauf beschrieben. Sie besteht darin, dass 2 ein weiteres Thiophenmolekül angreift und sich die Zwischenstufe 3a bildet. Dieser Schritt ist beliebig oft wiederholbar, wodurch also eine beliebig lange Polythiophenkette entstehen kann. Andernfalls kann ausgehend von der Zwischenstufe 3a durch Oxidation das Dikation 3b entstehen.
Die zweite denkbare Verlauf der Reaktion ausgehend von 2 ist eine Abbruchreaktion (unten). Durch diese bildet sich das Dikation 3b aus. 3b dissoziiert anschließend, sodass das Dithiophen (4) entsteht.
Chemische Synthese
Die chemische Synthese ist insbesondere für regioreguläre Polythiophenketten relevant. Häufig lässt sich durch regioselektive Teilreaktionen eine starke Regioregularität des Kettenverlaufes erzeugen. Es haben sich im Wesentlichen drei Verfahren für die chemische Synthese etabliert:
1. Rieke-Methode
Die Rieke–Methode beruht auf der Verwendung von Rieke–Zink (Zn*) und 2,5-Dibromthiophen (1, R= Alkylrest):
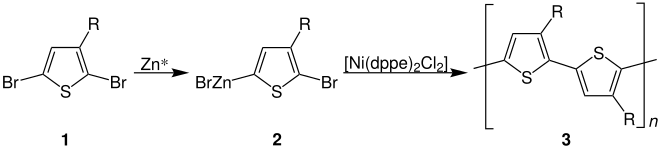
Dieses besonders reaktionsfreudige Zink wird bei sehr niedrigen Temperaturen zugegeben und führt regioselektiv zur Bildung der zinkorganischen Verbindung 2.[4] 2 reagiert anschließend als Monomer unter Zugabe eines Nickelchlorid-Komplexes mit dppe und bildet das hoch regioreguläre (Kopf–Schwanz) Polyalkylthiophen 3 aus.[4]
2. McCullough-Methode
Die McCullough–Methode folgt einem ähnlichen Prinzip wie die Rieke–Methode:[10]

Zunächst wird das Alkylthiophen (1, R= Alkylrest) durch das bekannte Bromierungsmittel N-Bromsuccinimid (NBS) bromiert, sodass das 2-Bromthiophen 2 entsteht. Anschließend wird 2 zunächst mit Lithiumdiisopropylamid (LDA) umgesetzt. Die daraus entstehende lithiumorganische Verbindung geht mit Magnesiumbromid (MgBr2) eine Transmetallierung ein und abschließend wird durch Zugabe des Nickelchlorid-dppp-Komplexes ([Ni(dppp)Cl2]) in einer Kumada-Kupplung das Alkylpolythiophen 3 gewonnen, welches durch die Regioselektivität der Reaktion eine hohe Regioregularität (Kopf–Schwanz) aufweist.
3. Oxidation durch Eisen(III)-chlorid/Eisen(III)-sulfat

In der Praxis spielt die Synthese von bestimmten Polythiophenen – wie Poly-3,4-ethylendioxythiophen – durch die Verwendung von Eisen(III)-Salzen eine wichtige Rolle. Der zugrunde liegende Mechanismus wurde historisch ab den 1980er Jahren vielfach diskutiert. Drei Mögliche Reaktionsverläufe sind denkbar. Schematisch bestehen alle Reaktionen aus den Elementen Oxidation, Deprotonierung und einem elektrophilen oder radikalischen Angriff der namensgebenden Zwischenstufe. Es sind drei mögliche Zwischenstufen vorgeschlagen, die den jeweiligen Ablauf der Reaktion bestimmen – Radikal (3a, oben),[11] Carbokation (2b, mittig),[12] Radikalkation (2c, unten).[13] Die Grafik zeigt exemplarisch die Bildung des Trimers aus einem Dimer.
Weblinks
Einzelnachweise
- Giovanna Barbarella, Alessandro Bongini, Massimo Zambianchi: Regiochemistry and Conformation of Poly(3-hexylthiophene) via the Synthesis and the Spectroscopic Characterization of the Model Configurational Triads. In: Macromolecules. 27. Jahrgang, Nr. 11, 1994, S. 3039–3045, doi:10.1021/ma00089a022.
- G. A. Diaz-Quijada: Regiochemical Analysis of Water Soluble Conductive Polymers: Sodium Poly(ω-(3-thienyl)alkanesulfonates). In: Macromolecules. 29. Jahrgang, Nr. 16, 1996, S. 5416–5421, doi:10.1021/ma960126.
- R. L. Elsenbaumer, K.-Y. Jen, G. G. Miller, H. Eckhardt, L. W. Shacklette, R. Jow: Poly (alkyl thiophenes) and Poly (substituted heteroaromatic vinylenes): Versatile, Highly Conductive, Processible Polymers with Tunable Properties. In Electronic Properties of Conjugated Polymers (Eds: Kuzmany, H.; Mehring, M.; Roth, S.), Springer, Berlin, 1987, ISBN 0-387-18582-8.
- Tian-An Chen, Xiaoming Wu, Reuben D. Rieke: Regiocontrolled Synthesis of Poly(3-alkylthiophenes) Mediated by Rieke Zinc: Their Characterization and Solid-State Properties. In: Journal of the American Chemical Society. 117. Jahrgang, 1995, S. 233, doi:10.1021/ja00106a027.
- St. Kirchmeyer, D. Gaiser, H. C. Starck GmbH & Co KG: Elektronische Bauelemente: Extrem flach und flexibel
- Andreas Elschner, Stephan Kirchmeyer, Wilfried Lovenich, Udo Merker, Knud Reuter: PEDOT: Principles and Applications of an Intrinsically Conductive Polymer. CRC Press, 2010, ISBN 978-1-4200-6912-9.
- Mael Nicolas, Frédéric Guittard, Serge Géribaldi: Synthesis of Stable Super Water- and Oil-Repellent Polythiophene Films. In: Angewandte Chemie. 2006, S. 2309–2312. doi:10.1002/ange.200503892.
- Guangtao Li, Sheshanath Bhosale, Tianyu Wang, Yang Zhang, Hesun Zhu, Jürgen-Hinrich Fuhrhop: Synthese von molekularen submikrometerlangen Polythiophen-Drähten im Gramm-Maßstab in mesoporösen Silicat-Matrices. In: Angewandte Chemie. 115. Jahrgang, 2003, S. 3948–3951, doi:10.1002/ange.200351158.
- J. Roncali, R. Garreau, A. Yassar, P. Marque, F. Garnier, M. Lemaire: Effects of steric factors on the electrosynthesis and properties of conducting poly(3-alkylthiophenes). In: The Journal of Physical Chemistry. 91. Jahrgang, Nr. 27, Dezember 1987, S. 6706–6714, doi:10.1021/j100311a030.
- Richard D. McCullough: The Chemistry of Conducting Polythiophenes. In: Advanced Materials. 10. Jahrgang, Nr. 2, Januar 1998, S. 93–116, doi:10.1002/(SICI)1521-4095(199801)10:2<93::AID-ADMA93>3.0.CO;2-F.
- V. M. Niemi, P. Knuuttila, J.-E. Österholm: Polymerization of 3-alkylthiophenes with FeCl3. In: Polymer. 33. Jahrgang, Nr. 7, 1992, S. 1559–1562, doi:10.1016/0032-3861(92)90138-M.
- M. R. Andersson, D. Selse, M. Berggren, H. Jaervinen, T. Hjertberg, O. Inganaes, J.-E. Oesterholm: Regioselective polymerization of 3-(4-octylphenyl)thiophene with FeCl3. In: Macromolecules. 27. Jahrgang, Nr. 22, Oktober 1994, S. 6503–6505, doi:10.1021/ma00100a039.
- Giovanna Barbarella, Massimo Zambianchi, Rosanna Di Toro, Martino Colonna Jr., Dario Iarossi, Francesca Goldoni, Alessandro Bongini: Regioselective Oligomerization of 3-(Alkylsulfanyl)thiophenes with Ferric Chloride. In: The Journal of Organic Chemistry. 61. Jahrgang, Nr. 23, November 1996, S. 8285–8292, doi:10.1021/jo960982j.