Pitzer-Spannung
Pitzer-Spannung heißt die nach dem Chemiker Kenneth Sanborn Pitzer (1914–1997, USA) benannte Ringspannung eines Moleküls, die durch Van-der-Waals-Abstoßung von ekliptisch und gauche angeordneten Substituenten (auch Wasserstoffatomen) benachbarter Atome hervorgerufen wird.[1] Pro ekliptischer Wechselwirkung sind dies etwa 17–21 kJ/mol (4–5 kcal/mol).
Aufgrund der Pitzer-Spannung ist z. B. Cyclopentan nicht planar. Obwohl es als ebenes Molekül mit einem C–C-Bindungswinkel von 108° fast frei von Valenzwinkelspannung wäre, bevorzugt es eine abgeknickte Briefumschlagform („envelope“-Form).[1] Die energetisch günstigen Konformationen sind also die sogenannte Briefumschlag-Konformation (engl. envelope conformation) gefolgt von der Halbsessel-Konformation (half-chair conformation):
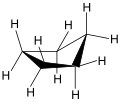 Briefumschlag-Konformation von Cyclopentan
Briefumschlag-Konformation von Cyclopentan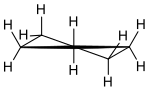 Halbsessel-Konformation von Cyclopentan
Halbsessel-Konformation von Cyclopentan
In cyclischen Verbindungen stellt die Pitzer-Spannung einen Teil der Gesamtringspannung dar, deren weitere Komponenten die Baeyer-Spannung oder Valenzwinkelspannung (vor allem vertreten im Dreiring und Vierring), die Newman-Spannung (1,5-Repulsion von Nicht-Wasserstoffatomen) und die Prelog-Spannung bzw. transannulare Wechselwirkung (vor allem bei größeren Ringen, Maximum beim Zehnring) sind.
Siehe auch
Literatur
- Adalbert Wollrab: Organische Chemie: Eine Einführung für Lehramts- und Nebenfachstudenten. 3. Auflage. Springer DE, 2009, ISBN 3-642-00781-3, S. 57, 173 f.
- Jan Bülle, Aloys Hüttermann: Das Basiswissen der organischen Chemie die wichtigsten organischen Reaktionen im Labor und in der Natur. Thieme, Stuttgart 2000, ISBN 978-3-527-30847-7, S. 113, 114.
Weblinks
- Essentials 4: Cycloalkane (PDF-Datei, 128 kB) bei der Universität Düsseldorf
Einzelnachweise
- J. Clayden, N. Greeves, S. G. Warren: Organische Chemie. 2. Auflage. Springer, Berlin 2013, S. 410, ISBN 978-3-642-34715-3.