Pipecolinsäure
Pipecolinsäure, auch Piperidin-2-carbonsäure, ist in ihrer natürlichen L-Form eine nichtproteinogene Aminosäure. Sie entsteht aus L-Lysin entweder als Zwischenstufe beim Abbau der Aminosäure oder über α-Desaminierung mit anschließender Cyclisierung und Reduktion.[6]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
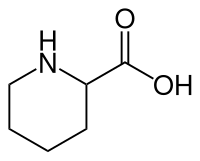 | |||||||||||||||||||
| Vereinfachte Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Pipecolinsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H11NO2 | ||||||||||||||||||
| Kurzbeschreibung |
weißes Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 129,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
1,04 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| pKS-Wert |
2,36 (Racemat)[4] | ||||||||||||||||||
| Löslichkeit |
löslich in Wasser[5] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Isomere
Die Pipecolinsäure besitzt ein Stereozentrum, somit ist sie optisch aktiv und es existieren zwei Enantiomere: L-Pipecolinsäure [Synonym: (S)-Pipecolinsäure] und die spiegelbildlich aufgebaute D-Pipecolinsäure [Synonym: (R)-Pipecolinsäure]. Ein 1:1-Gemisch aus D- und L-Form wird als Racemat oder DL-Pipecolinsäure bezeichnet.
| Isomere von Pipecolinsäure | ||
| Name | L-Pipecolinsäure | D-Pipecolinsäure |
| Andere Namen | (S)-Pipecolinsäure (−)-Pipecolinsäure | (R)-Pipecolinsäure (+)-Pipecolinsäure |
| Strukturformel | -Pipecolic_acid.svg.png.webp) |
-Pipecolic_acid.svg.png.webp) |
| CAS-Nummer | 3105-95-1 | 1723-00-8 |
| 535-75-1 (Racemat) | ||
| EG-Nummer | 221-462-1 | 217-024-4 |
| 208-616-3 (Racemat) | ||
| ECHA-Infocard | 100.019.511 | 100.015.477 |
| 100.007.835 (Racemat) | ||
| PubChem | 439227 | 736316 |
| 849 (Racemat) | ||
| Wikidata | Q27104171 | Q27104476 |
| Q7197255 (Racemat) | ||
Vorkommen
Pipecolinsäure wurde in verschiedenen Mikroorganismen[7], Pflanzen und Tieren[8] gefunden. In den Pflanzen hat Pipecolinsäure eine wichtige Rolle als Regulator pflanzlicher Resistenzreaktionen.[9] Sie wurde auch im Murchison-Meteorit nachgewiesen.[10]
Gewinnung und Darstellung
Die Synthese der natürlichen, nicht-proteinogenen racemischen Pipecolinsäure ist seit langem bekannt. Eine Synthesevariante ist die katalytische Reduktion von α-Picolinsäure und anschließende Racemattrennung mittels fraktionierender Kristallisation mit Weinsäure. Das natürlich vorkommende (S)-Enantiomer kann durch unterschiedliche Cyclisierungsreaktionen ausgehend von (S)-Lysin dargestellt. In neuerer Zeit wurden weitere, sowohl diastereoselektive als auch enantioselektive Synthesevarianten beschrieben.[11]
Verwendung
Die Bestimmung der Pipecolinsäure wird in der medizinischen Diagnostik verwendet bei:
- neonatalen Anfällen bzw. bei Verdacht auf Pyridoxin-abhängige Epilepsie (Bestimmung mittels Gaschromatographie/Massenspektrometrie)[12]
- Verdacht auf Zellweger-Syndrom[13]
Einzelnachweise
- Datenblatt Pipecolinic acid, 98% bei Sigma-Aldrich, abgerufen am 28. Januar 2016 (PDF).
- Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons. William Andrew, 2014, ISBN 978-0-323-29060-9, S. 281 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Piperidincarbonsäuren. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. Januar 2016.
- Eintrag zu Pipecolic acid in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 29. Januar 2016. (Seite nicht mehr abrufbar)
- Shmuel Yannai: Dictionary of Food Compounds with CD-ROM, Second Edition. CRC Press, 2012, ISBN 978-1-4200-8352-1, S. 1602 (eingeschränkte Vorschau in der Google-Buchsuche).
- spektrum.de: L-Pipecolinsäure - Lexikon der Biologie, abgerufen am 28. Januar 2016.
- Gerhard Habermehl, Peter E. Hammann: Naturstoffchemie - Eine Einführung. Springer-Verlag, 2013, ISBN 978-3-662-08929-3, S. 152 (eingeschränkte Vorschau in der Google-Buchsuche).
- H. Michl: Über das Vorkommen von Pipecolinsäure in tierischen Giften. In: Monatshefte für Chemie. 88, 1957, S. 701, doi:10.1007/BF00901355.
- dfg.de: DFG GEPRIS - Stoffwechsel und Signaltransduktion des pflanzlichen Immunsignals Pipecolinsäure, abgerufen am 28. Januar 2016.
- K. A. Kvenvolden, J. G. Lawless, C. Ponnamperuma: Nonprotein Amino Acids in the Murchison Meteorite. In: Proceedings of the National Academy of Sciences. 68, 1971, S. 486, doi:10.1073/pnas.68.2.486.
- Westerhoff, Ole (2002): Darstellung unnatürlicher α-Aminosäurederivate durch Additionsreaktionen an acyclische und cyclische Imine. Dissertation, Universität Oldenburg. urn:nbn:de:gbv:715-oops-3390
- kup.at: Abklärung angeborener Stoffwechselerkrankungen mit dem Leitsymptom Epilepsie, abgerufen am 28. Januar 2016.
- kindernetzwerk.de: Krankheitsübersichten - Zellweger-Syndrom, abgerufen am 28. Januar 2016.
