Perfluorcarbone
Perfluorcarbone (PFC), auch perfluorierte Kohlenwasserstoffe oder Fluorcarbone[1] genannt, sind vollständig mit Fluor substituierte Kohlenstoffverbindungen (d. h. sie enthalten keine Wasserstoff-Atome mehr). Sie gehören zu den Fluorkohlenwasserstoffen (FKW; englisch Hydrofluorocarbons, HFC), fluorierte Derivate der Kohlenwasserstoffe.
.svg.png.webp)

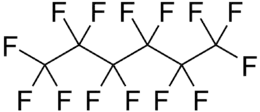
Einfache Kohlenstoffketten wie das perfluorierte Octanderivat Perfluoroctan (C8F18), sind ebenso verbreitet wie komplexe, cyclische Fluor-Kohlenstoffverbindungen. Der formal einfachste Vertreter ist das Tetrafluormethan (CF4), gefolgt vom Difluoracetylen (C2F2).
Ein Teil der Perfluorcarbone gehört gemäß OECD-Definition zu den per- und polyfluorierten Alkylverbindungen,[2][3] die veraltet ebenfalls noch mit PFC abgekürzt werden.
Eigenschaften
Die CF2-Einheiten in Perfluorcarbonen sind helikal angeordnet, während Alkane eine Zickzack-Anordnung aufweisen. Lineare Perfluorcarbone bilden bei 7 CF2-Einheiten tetragonal angeordnete Monolayer. Ab 9 CF2-Einheiten sind diese hexagonal angeordnet. Grund dafür sind die Dipol-Dipol-Wechselwirkungen.[4]
Verwendung
Verwendung finden Perfluorcarbone als Kältemittel und als flüssiger Isolierstoff z. B. in Transformatoren.
Das Polymerisat Polytetrafluorethylen (PTFE), bekannt auch unter dem Handelsnamen Teflon®, ist ein Thermoplast mit hohem Schmelzpunkt von über 300 °C. Es ist chemisch kaum angreifbar und findet vielerlei Anwendung in Haushalt und Technik.
Medizinischen Einsatz finden PFC in der Augenheilkunde.[5] Des Weiteren können Perfluorcarbone zur Flüssigkeitsbeatmung eingesetzt werden. Viele Perfluorcarbone haben eine niedrige Oberflächenspannung und breiten sich aufgrund des hohen Ausbreitungskoeffizienten sehr leicht auf Oberflächen aus. Diesen Eigenschaften und dem großen Potential zum Transport von Gasen wie Sauerstoff, Kohlenstoffdioxid oder Stickstoffmonoxid verdanken Perfluorcarbone ihren Einsatz bei der Beatmung.[6]
PFC werden mitunter als Dopingmittel verwendet, da sie ähnlich wie rote Blutkörperchen den Sauerstoff transportieren. Sie können in Dopingtests beispielsweise gaschromatographisch nachgewiesen werden.[7]
Analytik
PFC, wie etwa Perfluoroctan, können mittels Massenspektrometrie nachgewiesen werden. Zur Ionisierung eignen sich hierbei plasmabasierende Methoden, wie die chemische Ionisation bei Atmosphärendruck (APCI) oder die stille elektrische Entladung (DBDI).[8][9]
Umweltwirkungen
Aufgrund ihrer sehr langen mittleren Verweilzeit in der Atmosphäre haben alle Perfluorcarbone, ähnlich wie die Fluorchlorkohlenwasserstoffe (FCKW), sehr hohe Treibhauspotentiale.[10]
Biologisch verhalten sich Perfluorcarbone bis auf wichtige Ausnahmen inert: wesentliches Charakteristikum für die biologische Unbedenklichkeit ist die fehlende Eigenschaft der Perfluorcarbone zur Bildung von Radikalen, doch genau diese Eigenschaft ist kennzeichnend für persistierende Stoffe. Uneinigkeit besteht derzeit darüber, ob und in welcher Form inkorporierte Perfluorcarbone in der Lage sind, intra- und interzelluläre Signalwege direkt zu beeinflussen.
Weblinks
Einzelnachweise
- fluorocarbons. In: Alan D. McNaught, Andrew Wilkinson, IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. 2. Auflage. Blackwell Scientific Publications, Oxford 1997, ISBN 0-9678550-9-8, doi:10.1351/goldbook.F02459 (englisch, korrigierte Fassung – erstellt von M. Nic, J. Jirat, B. Kosata; mit Aktualisierungen von A. Jenkins – Version: 2.3.3).
- OECD: Reconciling Terminology of the Universe of Per- and Polyfluoroalkyl Substances: Recommendations and Practical Guidance, OECD Series on Risk Management, No. 61, OECD Publishing, Paris, 2021, S. 23.
- Zhanyun Wang, Andreas M. Buser, Ian T. Cousins, Silvia Demattio, Wiebke Drost, Olof Johansson, Koichi Ohno, Grace Patlewicz, Ann M. Richard, Glen W. Walker, Graham S. White, Eeva Leinala: A New OECD Definition for Per- and Polyfluoroalkyl Substances. In: Environmental Science & Technology. November 2021, doi:10.1021/acs.est.1c06896.
- Takeshi Hasegawa: Physicochemical Nature of Perfluoroalkyl Compounds Induced by Fluorine. In: The Chemical Record. Band 17, Nr. 10, Oktober 2017, S. 903–917, doi:10.1002/tcr.201700018.
- Günter K. Kriegelstein (Hrsg.): Glaukom 2005. Ein Diskussionsforum. Springer, Berlin u. a. 2005, ISBN 3-540-29677-8, S. 81.
- Sigrid Schäfer, Frank Kirsch, Gottfried Scheuermann, Rainer Wagner: Fachpflege Beatmung. 5. Auflage. Elsevier, Urban & Fischer, München u. a. 2009, ISBN 978-3-437-25183-2, S. 238.
- Neal E. Flomenbaum, Lewis R. Goldfrank, Robert S. Hoffman, Mary Ann Howland, Neal A. Lewin (Hrsg.): Goldfrank’s Toxicologic Emergencies. 8. Auflage, McGraw-Hill, New York u. a. 2006, ISBN 0-07-147914-7, S. 691.
- Schütz et al.: Dielectric Barrier Discharge Ionization of Perfluorinated Compounds. In: Anal. Chem. Band 87, Nr. 22, 2015, S. 11415–11419, doi:10.1021/acs.analchem.5b03538.
- Gyr et al.: Mechanistic Understanding Leads to Increased Ionization Efficiency and Selectivity in Dielectric Barrier Discharge Ionization Mass Spectrometry: A Case Study with Perfluorinated Compounds. In: Anal. Chem. Band 87, Nr. 22, 2018, S. 11415–11419, doi:10.1021/acs.analchem.7b04711.
- Piers Forster, Venkatachalam Ramaswamy et al.: Changes in Atmospheric Constituents and in Radiative Forcing. In: Susan Solomon et al. (Hrsg.): Climate Change 2007. The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press, Cambridge u. a. 2007, ISBN 978-0-521-88009-1, S. 212–213, (PDF; 7,67 MB).