Pentazol
Pentazol ist eine chemische Verbindung und formal der höchstsubstituierte Vertreter der Gruppe der Azole. Das Besondere am Pentazol ist, dass es im Gegensatz zu anderen Heterocyclen keinen Kohlenstoff enthält, sondern praktisch nur aus Stickstoff besteht. Es ist somit ein seltener Fall eines anorganischen, aromatischen Moleküls und streng genommen kein Heterocyclus, sondern ein Homocyclus. Unter Standardbedingungen ist Pentazol nicht stabil, konnte aber bei hohen Drücken nachgewiesen werden. Größte reale Bedeutung haben Pentazol-Derivate bisher als Übergangszustände bei der Bildung von organischen Aziden aus Diazoverbindungen und Azidsalzen, auch wenn bei solchen Reaktionen andere, offenkettige Übergangszustände eine übergeordnete Rolle spielen.[2][3][4] Es sind wenige metastabile Derivate bekannt.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
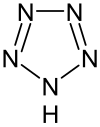 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Pentazol | ||||||||||||
| Andere Namen |
1H-Pentazol (IUPAC) | ||||||||||||
| Summenformel | HN5 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 71,02 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Gewinnung und Darstellung
Pentazol selbst als neutrale Verbindung konnte bis heute nicht synthetisiert werden. Das Pentazolatanion jedoch wurde erstmals 2016 von Boris Bazanov et al. in der Flüssigphase beobachtet. Dort konnte es durch Reduktion von Phenylpentazol[5] mit Natrium oder Kalium in Tetrahydrofuran als Lösungsmittel entstehen. Die Reaktion begann bei −40 °C, wo bloß ein Radikalanion des Edukts erzeugt wurde. Der Zerfall dieses Radikalanions in ein Phenylradikal und das Pentazolatanion erfolgte bei Raumtemperatur.[6]
Eigenschaften
Physikalische Eigenschaften
Nach Berechnungen von Steele und Oleynik sollte Pentazol bei 50 GPa als salzartiger Feststoff mit einem Proton als Kation und dem Pentazolatanion vorliegen. Bei 30 GPa sollte in der Wasserstoff-Stickstoff-Phase das Ammoniumpentazolat H4N6 stabil sein.[7]
Bekannte Derivate
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- R. Huisgen, I. Ugi: Zur Lösung eines klassischen Problems der organischen Stickstoff-Chemie. In: Angewandte Chemie. Band 68, Nr. 22, 1956, S. 705–706, doi:10.1002/ange.19560682212.
- R. Huisgen, I Ugi: Pentazole, I. Die Lösung Eines Klassischen Problems der Organischen Stickstoffchemie. In: Chemische Berichte. Band 90, Nr. 12, 1957, S. 2914–2927, doi:10.1002/cber.19570901230.
- L. A. Burke, P. J. Fazen: Correlation analysis of the interconversion and nitrogen loss reactions of aryl pentazenes and pentazoles derived from aryl diazonium and azide ions. In: International Journal of Quantum Chemistry. Band 109, Nr. 15, 2009, S. 3613–3618, doi:10.1002/qua.22408.
- Externe Identifikatoren von bzw. Datenbank-Links zu Phenylpentazol: CAS-Nummer: 32785-44-7, PubChem: 71361153, ChemSpider: 29334017, Wikidata: Q82750319.
- B. Bazanov, U. Geiger, R. Carmieli, D. Grinstein, S. Welner, Y. Haas: Detection of cyclo-N5- in THF solution. In: Angewandte Chemie International Edition. Band 55, Nr. 42, 2016, S. 13233–13235, doi:10.1002/anie.201605400.
- B. A. Steele, I. I. Oleynik: Pentazole and ammonium pentazolate: Crystalline hydro-nitrogens at high pressure. In: The Journal of Physical Chemistry A. Band 121, Nr. 8, 2017, S. 1808–1813, doi:10.1021/acs.jpca.6b12900.
- C. Zhang, C. Sun, B. Hu, C Yu, M Lu: Synthesis and characterization of the pentazolate anion cyclo-N5 in (N5) 6 (H3O) 3 (NH4) 4Cl. In: Science. Band 355, Nr. 6323, 2017, S. 374–376, doi:10.1126/science.aah3840.
- Externe Identifikatoren von bzw. Datenbank-Links zu 4-Dimethylaminophenylpentazol: CAS-Nummer: 58402-54-3, PubChem: 23279314, ChemSpider: 10447638, Wikidata: Q4637137.