Hydrate
Hydrate (altgriechisch ὕδωρ hydōr ‚Wasser‘) sind in der Chemie allgemein Substanzen, die Wasser enthalten. Dabei wird die Bezeichnung in verschiedenen Bereichen der Chemie etwas unterschiedlich behandelt. Im Gegensatz zu den Hydraten stehen die Anhydride, Verbindungen, denen Wasser entzogen wurde.
Anorganische Hydrate
Anorganische Hydrate sind Solvate, sie enthalten also molekulares Wasser, etwa als Kristallwasser. Neben kristallwasserhaltigen Kristallen werden auch Komplexe, die Wasser-Liganden besitzen, als Hydrate bezeichnet. Kristallwasserlose Substanzen werden auch als Anhydrate bezeichnet.
Das Kristallwasser in Hydraten kann durch Wasserstoffbrücken oder andere zwischenmolekulare Kräfte an bestimmte Ionen gebunden sein, es kann jedoch auch der Fall sein, dass es vor allem deshalb eingebaut wird, weil dadurch eine günstigere Kristallstruktur entsteht. In kristallinen Hydraten gibt es bestimmte stöchiometrische Verhältnisse zwischen Ionenverbindung und Kristallwasser. In vielen Fällen sind auch mehrere Hydrate mit unterschiedlichen Kristallwassermengen möglich, so sind von Natriumcarbonat Modifikationen mit einem, zwei, fünf, sieben und zehn Äquivalenten Kristallwasser sowie das kristallwasserlose Natriumcarbonat bekannt.
Hydrate entstehen durch Hydratation, meist während der Kristallisation aus wässrigen Lösungen. Kristallwasserreiche Hydrate können, etwa durch Erhitzen, entwässert werden, so dass entweder andere, weniger Kristallwasser enthaltende Hydrate entstehen oder die wasserfreie Verbindung, dabei treten zugleich oft Farbänderungen ein, z. B. beim Cobalt(II)-chlorid:
_chloride.jpg.webp) Cobalt(II)-chlorid (wasserfrei)
Cobalt(II)-chlorid (wasserfrei)
CoCl2-chloride-hexahydrate-sample.jpg.webp) Cobalt(II)-chlorid-Hexahydrat
Cobalt(II)-chlorid-Hexahydrat
CoCl2 · 6 H2O
Für die Kennzeichnung von Hydraten in Summenformeln wird dieses nicht direkt in die Formel mit eingefügt, sondern als · n H2O ans Ende der Summenformel gesetzt (n ist dabei die Menge an Kristallwasser, die pro Formeleinheit im Kristall auftritt). CaSO4 · 2 H2O beschreibt beispielsweise Calciumsulfat mit zwei Äquivalenten Kristallwasser, was Gips entspricht. Zur Benennung wird dem Namen der Verbindung ein -xxxhydrat angefügt, wobei xxx ein griechisches oder lateinisches Zahlwort für die Äquivalentanzahl an Kristallwasser ist. Gips heißt systematisch dementsprechend Calciumsulfat-Dihydrat.
| Name | Zahl der Wassermoleküle | Beispiele (Salze) | chem. Formel |
|---|---|---|---|
| Anhydrat | 0 | Magnesiumchlorid-Anhydrat | MgCl2 |
| Hemihydrat | 1⁄2 | Calciumsulfat-Hemihydrat | CaSO4 · 0,5 H2O |
| Monohydrat | 1 | Natriumhydrogensulfat-Monohydrat Caesiumthiosulfat-Monohydrat | NaHSO4 · H2O Cs2[S2O3] · H2O |
| Sesquihydrat | 1,5 | Kaliumcarbonat-Sesquihydrat | K2CO3 · 1,5 H2O |
| Dihydrat | 2 | Calciumsulfat-Dihydrat, Calciumchlorid-Dihydrat | CaSO4 · 2 H2O CaCl2 · 2 H2O |
| Trihydrat | 3 | Natriumacetat-Trihydrat, Blei(II)-acetat-Trihydrat | NaC2H3O2 · 3 H2O PbC4H6O4 · 3 H2O |
| Tetrahydrat | 4 | Kaliumnatriumtartrat-Tetrahydrat | KNaC4H4O6 · 4 H2O |
| Pentahydrat | 5 | Kupfersulfat-Pentahydrat | CuSO4 · 5 H2O |
| Hexahydrat | 6 | Aluminiumchlorid-Hexahydrat, Cobalt(II)-chlorid-Hexahydrat Magnesiumchlorid-Hexahydrat | AlCl3 · 6 H2O CoCl2 · 6 H2O MgCl2 · 6 H2O |
| Heptahydrat | 7 | Magnesiumsulfat-Heptahydrat, Eisen(II)-sulfat-Heptahydrat, Zink(II)-sulfat-Heptahydrat | MgSO4 · 7 H2O FeSO4 · 7 H2O ZnSO4 · 7 H2O |
| Octahydrat | 8 | Praseodym(III)-sulfat-Octahydrat | Pr2(SO4)3 · 8 H2O |
| Nonahydrat | 9 | Chrom(III)-nitrat-Nonahydrat, Natriumsulfid-Nonahydrat, Aluminiumnitrat-Nonahydrat | Cr(NO3)3 · 9 H2O, Na2S · 9 H2O, Al(NO3)3·9 H2O |
| Decahydrat | 10 | Natriumsulfat-Decahydrat (Glaubersalz), Natriumcarbonat-Decahydrat | Na2SO4 · 10 H2O Na2CO3 · 10 H2O |
| Undecahydrat | 11 | Magnesiumchromat-Undecahydrat | Mg[CrO4] · 11 H2O |
| Dodecahydrat | 12 | Natriumphosphat-Dodecahydrat | Na3PO4 · 12 H2O |
Organische Hydrate
In der organischen Chemie werden hydratisierte Verbindungen als Hydrate bezeichnet. Dies sind meist keine Verbindungen, die molekulares Wasser enthalten, sondern solche, bei denen Wasser durch eine Additionsreaktion chemisch zu einer Verbindung hinzugefügt wurde. Beispiele hierfür sind geminale Diole oder Aldehydhydrate, bei denen es sich um hydratisierte Aldehyde handelt:
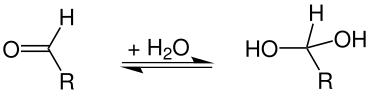
Die meisten Aldehydhydrate sind instabil, Ausnahmen sind Chloralhydrat, Formalin. Geminale Triole (Orthocarbonsäuren = hydratisierte Carbonsäuren) sind genau wie die Orthokohlensäure (Tetrahydroxymethan) hingegen nur in Form ihrer Ester stabil.
Es gibt auch stabile organische Verbindungen, die Hydratwasser enthalten, beispielsweise das (R)-Cystein·Hydrochlorid·Monohydrat [L-Cystein·Hydrochlorid·Monohydrat], welches in technischem Maßstab hergestellt wird.
Gashydrate
Bei Gashydraten wird im Gegensatz zu kristallwasserhaltigen Substanzen nicht das Wasser in der Substanz, sondern eine sonst gasförmige Verbindung wie Methan, Schwefelwasserstoff oder Kohlenstoffdioxid in Eis eingeschlossen. Dabei bildet sich ein Clathrat, eine Einschlussverbindung ohne große physikalische Anziehungskräfte zwischen Eis und Gas. Das bekannteste Gashydrat ist Methanhydrat.
Kohlenhydrate
Kohlenhydrate enthalten im Namen zwar -hydrat, gehören jedoch nicht zu den Hydraten.
Literatur
- Eintrag zu Hydrate. In: Römpp Online. Georg Thieme Verlag