Pelargonidin
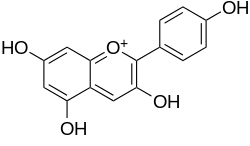
Pelargonidin (3,5,7,4′-Tetrahydroxyflavyliumkation) ist ein chemischer Stoff aus der Gruppe der Anthocyanidine.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Pelargonidin | ||||||||||||
| Andere Namen |
3,4′,5,7-Tetrahydroxyflavyliumchlorid,3,5,7-trihydroxy-2-(4-hydroxyphenyl)-1-benzopyrylium | ||||||||||||
| Summenformel | C15H11ClO5 | ||||||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff (Chlorid)[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 306,70 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
teilweise löslich in Wasser (Chlorid)[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Pelargonidin ist in glycosidischer Form in höheren Pflanzen weit verbreitet und bewirkt die rötliche Färbung vieler Blütenblätter und Früchte.
Geschichte
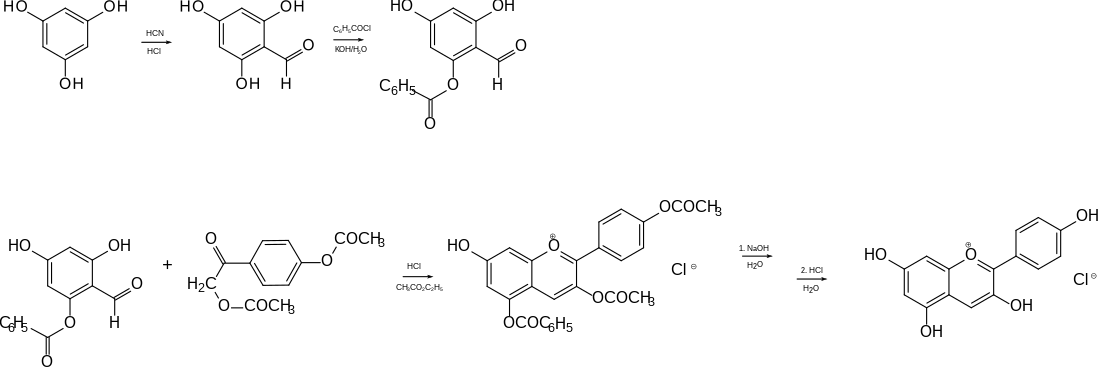
Die Blütenblätter von Pelargonien fallen durch ihre meist roten Farben auf. Der Farbstoff einer sogenannten Scharlachpelargonie, vermutlich Pelargonium inquinans (L.) L’Hér, wurde erstmals von A. B. Griffiths extrahiert und Pelargonidin genannt. Die Substanz wurde von Richard Willstätter und Elmer K. Bolton genauer untersucht.[3][4] Die erste Synthese gelang Thomas Malkin im Arbeitskreis von Robert Robinson.[5] Weitere Synthesen wurden später publiziert. Zur Isolierung des in der Pflanze an Fruchtsäuren gebundenen Pelargonidins wurde durch Umsetzung mit Salzsäure das kommerziell erhältliche, kristalline Pelargonidinchlorid hergestellt.[2]
Eine Synthese beruht auf der Kondensation zweier Bausteine, deren OH-Gruppen zum Teil geschützt werden mussten. Der erste Baustein wurde aus Resorcin hergestellt, das durch Formylierung nach Gattermann 2,4,6-Trihydroxybenzaldehyd lieferte. Der zweite Baustein war das Diacetat von ω-4-Dihydroxy-acetophenon (systematischer Name: 2,4′-Diacetoxy-1-phenylethanon). Saure Kondensation bei Raumtemperatur führte zum geschützten Flavylium-Kation. Die Schutzgruppen wurden durch Behandlung (Verseifung) mit Natronlauge entfernt. Mit Salzsäure erhielt man Pelargonidinchlorid.[6]
Biologische Bedeutung
Pelargonidin ist als Aglykon mit verschiedenen Kohlenhydraten (Zuckern) verknüpft. Mit Glucose bildet es ein 3-Glucosid (Pelargonidin-3-O-glucosid) und ein 3,5-Diglucosid.
Weblinks
- Pelargonidin im Lexikon der Biochemie auf spektrum.de
Einzelnachweise
- Datenblatt Pelargonidin (PDF) bei Carl Roth, abgerufen am 17. Mai 2020.
- Datenblatt Pelargonidin chloride, bei Sigma-Aldrich, abgerufen am 1. Dezember 2021 (PDF).
- A. B. Griffiths: Die Pigmente des Geraniums und anderer Pflanzen. In: Berichte der deutschen chemischen Gesellschaft. Band 36, Nr. 4, 1903, S. 3959–3961, doi:10.1002/cber.19030360451. Zitiert nach Richard Willstätter, Elmer K. Bolton: Untersuchungen über die Anthocyane. IV. Über den Farbstoff der Scharlachpelargonie. In: Justus Liebigs Annalen der Chemie. Band 408, Nr. 1, 1915, S. 42–61, doi:10.1002/jlac.19154080104.
- Richard Willstätter, Elmer K. Bolton: Untersuchungen über die Anthocyane. IV. Über den Farbstoff der Scharlachpelargonie. In: Justus Liebigs Annalen der Chemie. Band 408, Nr. 1, 1915, S. 42–61, doi:10.1002/jlac.19154080104.
- Thomas Malkin, Robert Robinson: CLXIV. — A synthesis of pyrylium salts of anthocyanidin type. Part VIII. A new synthesis of pelargonidin chloride and of galanginidin chloride. In: Journal of the Chemical Society, Transactions. Band 127, 1925, S. 1190–1195, doi:10.1039/CT9252701190.
- John Arthur Joule, George Fouet Smith: Heterocyclic Chemistry. 2. Aufl. Van Nostrand Reinhold Company, New York 1978, S. 181.