Pazopanib
Pazopanib ist ein Arzneistoff aus der Gruppe der Tyrosinkinase-Inhibitoren. Die oral einzunehmende Substanz wurde 2010 in der EU zur Behandlung des fortgeschrittenen und/oder metastasierten Nierenzellkarzinoms zugelassen. 2012 erfolgte eine Zulassungserweiterung für ausgewählte Subtypen eines fortgeschrittenen Weichteilsarkoms.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
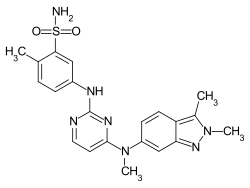 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Pazopanib | |||||||||||||||
| Andere Namen |
5-((4-((2,3-Dimethyl-2H-indazol-6-yl)methylamino)-2-pyrimidinyl)amino)-2-methylbenzolsulfonamid | |||||||||||||||
| Summenformel | C21H23N7O2S | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
L01XE11 | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 437,517 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Wirkung
Der Tyrosinkinasehemmer hemmt wichtige Signaltransduktionswege in den Tumorzellen und unterbindet andererseits die Neubildung von Blutgefäßen, welche den Tumor versorgen. Die Wirkung tritt über die Hemmung mehrerer Tyrosinkinasen (VEGFR, PDGFR, KIT) ein. Die Plasmahalbwertszeit liegt bei 30 Stunden, weswegen die Einnahme meist einmal täglich, mit einem zeitlichen Abstand zur Mahlzeit, erfolgt.
Studienlage
Nierenzellkarzinom
Im Juni 2010 wurde Pazopanib durch die Europäische Arzneimittelagentur (EMA) zur Behandlung des Nierenzellkarzinoms in der Erstlinientherapie und für Nierenzellkarzinom-Patienten, die zuvor eine Therapie mit Zytokinen erhalten hatten, zugelassen.[2] Grundlage der Zulassung waren die Ergebnisse einer 2010 publizierten 2:1-randomisierten Phase-III-Studie, in deren Rahmen 435 Patienten mit fortgeschrittenem Nierenzellkarzinom entweder mit 800 mg Pazopanib täglich, oder mit Placebo behandelt wurden.[3] Das mediane progressionsfreie Überleben der mit Pazopanib behandelten Patienten war mit 9,2 Monaten (95-%-Konfidenzintervall KI: 7,4–12,9 Monate) verglichen zu Placebo-Patienten (4,2 Monate; KI: 2,8–4,2) signifikant länger. Zum Analysezeitpunkt war auch das Gesamtüberleben der ersten Gruppe verlängert (21,2 Monate verglichen zu 19,3 Monaten), allerdings war der Unterschied nicht signifikant.
Eine im Jahr 2013 im New England Journal of Medicine veröffentlichte Studie verglich die ältere Standardtherapie Sunitinib mit Pazopanib. 1110 Patienten mit metastasiertem klarzelligen Nierenzellkarzinom erhielten entweder 800 mg Pazopanib durchgehend täglich, oder 50 mg Sunitinib täglich für 4 Wochen, jeweils gefolgt von 2 Wochen Pause. Die Studie war als Nichtunterlegenheitsstudie angelegt. Die Pazopanib-Patienten wiesen mit 8,4 Monaten (95 % KI: 8,3 bis 10,9) verglichen zu den Sunitinib-Patienten mit 9,5 Monaten (95 % KI: 8,3 bis 11,1) ein statistisch nicht geringeres progressionsfreies Überleben auf, womit die Wirkungsäquivalenz gezeigt war. Vom Nebenwirkungsspektrum war Pazopanib in allen untersuchten Parametern jedoch deutlich besser verträglich.[4]
Weichteilsarkome
Grundlage der Zulassung zur Therapie von Weichteilsarkomen war die im Jahr 2012 veröffentlichte sogenannte PALETTE-Therapiestudie.[5] Im Rahmen dieser großen multinationalen Studie wurden 369 Weichteilsarkom-Patienten 2:1 randomisiert entweder mit 800 mg Pazopanib oder Placebo behandelt. Die Studie wurde von GlaxoSmithKline finanziert. Das mediane progressionsfreie Überleben betrug 4,6 Monate (95 %-KI 3,7–4,8) in der Pazopanib-Gruppe gegenüber 1,8 Monaten (0,9–1,8) in der Placebo-Gruppe. Für das mediane Gesamtüberleben waren die Daten 12,5 Monate (10,6–14,8) gegenüber 10,7 Monaten (8,7–12,8).
Allerdings wurden nur Patienten mit bestimmten Weichteilsarkom-Typen in die PALETTE-Studie eingeschlossen, weswegen die Wirksamkeit von Pazopanib nur für diese Subtypen gezeigt wurde. Patienten mit den folgenden Sarkomtypen waren in dieser Studie ausgeschlossen: Adipozytisches Sarkom (alle Subtypen); alle Rhabdomyosarkome, die nicht alveolär oder pleomorph sind; Dermatofibrosarcoma protuberans; inflammatorisches myofibroblastisches Sarkom; malignes Mesotheliom und gemischte mesodermale Tumoren des Uterus. Infolge dieser Studie wurde Pazopanib durch die Europäische Arzneimittelagentur EMA zur Behandlung von erwachsenen Patienten mit ausgewählten Subtypen eines fortgeschrittenen Weichteilsarkoms zugelassen. Die Zulassung erfolgte für Patienten, die vorher eine Chemotherapie ihrer metastasierten Erkrankung erhalten hatten oder die innerhalb von 12 Monaten nach einer (neo-)adjuvanten Therapie ein erneutes Fortschreiten ihrer Erkrankung aufwiesen.[6]
Kontraindikationen
Nicht verabreicht werden darf Pazopanib bei Überempfindlichkeit und schwerer Leberfunktionsstörung.
Nebenwirkungen
Häufige unerwünschte Nebenwirkungen sind Verdauungsstörungen (Appetitlosigkeit, Bauchschmerzen, Durchfall, Übelkeit, Erbrechen, Geschmacksstörungen), Erhöhung der Leberenzyme, Hypertonie, Müdigkeit und Veränderungen der Haarfarbe. Die Leberenzymstörungen treten offensichtlich früher als gedacht auf, weswegen der Hersteller häufige und strengere Kontrollen der Leberfunktion empfiehlt.[7]
Interaktionen
Als Substrat von CYP3A4 kann Pazopanib mit zahlreichen anderen Arzneimitteln interagieren.
Handelsnamen
Pazopanib ist in Form von Filmtabletten unter dem Namen Votrient erhältlich. Die übliche Tagesdosis beträgt 800 mg einmal täglich.
Weblinks
Einzelnachweise
- Datenblatt Pazopanib bei Sigma-Aldrich, abgerufen am 26. Dezember 2022 (PDF).
- Neue onkologische Arzneimittel: Pazopanib zur Behandlung des fortgeschrittenen Nierenzellkarzinoms. In: Der Arzneimittelbrief. Band 45, 2011 (online).
- Sternberg CN, Davis ID, Mardiak J, Szczylik C, Lee E, Wagstaff J, Barrios CH, Salman P, Gladkov OA, Kavina A, Zarbá JJ, Chen M, McCann L, Pandite L, Roychowdhury DF, Hawkins RE. Pazopanib in locally advanced or metastatic renal cell carcinoma: results of a randomized phase III trial. J Clin Oncol. 2010;28(6):1061-8. doi:10.1200/JCO.2009.23.9764
- Motzer RJ, Hutson TE, Cella D, Reeves J, Hawkins R, Guo J, Nathan P, Staehler M, de Souza P, Merchan JR, Boleti E, Fife K, Jin J, Jones R, Uemura H, De Giorgi U, Harmenberg U, Wang J, Sternberg CN, Deen K, McCann L, Hackshaw MD, Crescenzo R, Pandite LN, Choueiri TK. Pazopanib versus Sunitinib in Metastatic Renal-Cell Carcinoma. N Engl J Med. 2013;369(8):722-31. doi:10.1056/NEJMoa1303989
- van der Graaf WT, Blay JY, Chawla SP, Kim DW, Bui-Nguyen B, Casali PG, Schöffski P, Aglietta M, Staddon AP, Beppu Y, Le Cesne A, Gelderblom H, Judson IR, Araki N, Ouali M, Marreaud S, Hodge R, Dewji MR, Coens C, Demetri GD, Fletcher CD, Dei Tos AP, Hohenberger P; EORTC Soft Tissue and Bone Sarcoma Group; PALETTE study group: Pazopanib for metastatic soft-tissue sarcoma (PALETTE): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet. 2012;379(9829):1879-86. doi:10.1016/S0140-6736(12)60651-5.
- ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS: Votrient. (PDF) EMA, abgerufen am 13. Juli 2017.
- BfArM: Informationsbrief zu Votrient® (Pazopanib), 30. Juli 2013.