Polyethylenterephthalat
Polyethylenterephthalat (Kurzzeichen PET) ist ein durch Polykondensation hergestellter thermoplastischer Kunststoff aus der Familie der Polyester. PET hat vielfältige Einsatzbereiche und wird unter anderem zur Herstellung von Kunststoffflaschen (PET-Flaschen), Folien und Textilfasern verwendet. Im Jahr 2008 lag die Produktion bei 40 Millionen Tonnen. Trotz verstärktem Recycling in jüngerer Zeit erhöhte sich die Produktionsmenge bis 2016 auf 56 Millionen Tonnen.[7][8]
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
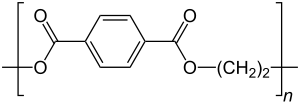 | |||||||
| Allgemeines | |||||||
| Name | Polyethylenterephthalat | ||||||
| Andere Namen | |||||||
| CAS-Nummer | 25038-59-9 | ||||||
| Monomere | Ethylenglycol und Terephthalsäure | ||||||
| Summenformel der Wiederholeinheit | C10H8O4 | ||||||
| Molare Masse der Wiederholeinheit | 192,17 g·mol−1 | ||||||
| Art des Polymers | |||||||
| Eigenschaften | |||||||
| Aggregatzustand |
fest | ||||||
| Dichte |
1,38 g·cm−3 (20 °C)[2] | ||||||
| Schmelzpunkt |
250–260 °C[3] | ||||||
| Glastemperatur |
70 °C[4] | ||||||
| Kristallinität |
teilkristallin[5] | ||||||
| Elastizitätsmodul |
4500 N·mm−2 längs und quer[4] | ||||||
| Wasseraufnahme |
0,5 %[4] | ||||||
| Löslichkeit |
praktisch unlöslich in Wasser[2] | ||||||
| Thermischer Ausdehnungskoeffizient |
7·10−5 K−1[6] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Geschichte
Polyethylenterephthalat geht auf eine Erfindung der beiden Engländer John Rex Whinfield und J. T. Dickson zurück. In den Laboren des Textilunternehmens Calico Printers Association in Accrington gelang ihnen 1941 erstmals die Herstellung eines Polyesters aus Ethylenglycol und Terephthalsäure sowie die Faserherstellung hieraus. In dem GB-Patent Nr. 578 079 wird diese Erfindung beschrieben.[9] Da sie in die Zeit des Zweiten Weltkriegs fiel, wurden die Erfindungsbeschreibung ebenso wie auch ein Nachfolgepatent zu Geheimpatenten erklärt. Da bei der Calico Printers Association weitere Entwicklungsarbeiten nicht durchgeführt werden konnten, wurden diese von einem britischen Regierungsinstitut übernommen. Wegen der dort beschränkten Möglichkeiten wurde Ende 1943 das britische Chemieunternehmen Imperial Chemical Industries (ICI) mit den weiteren Forschungs- und Entwicklungsarbeiten beauftragt. Außerdem drängte die britische Regierung auf eine vertragliche Vereinbarung zwischen der Calico Printers und der ICI zur Übernahme der Herstellungsrechte durch Letztere. Die ICI erhielt diese 1947 weltweit, mit Ausnahme der USA. Zwei Jahre später begann bei der ICI die Versuchsproduktion von Fasern aus Polyethylenterephthalat unter der Markenbezeichnung Terylene. Durch die Zusammenarbeit der ICI mit dem amerikanischen Chemiekonzern Du Pont waren Informationen über die Erfindung an dieses Unternehmen gelangt, wo ab 1944 eigene Entwicklungsarbeiten durchgeführt wurden. Du Pont erwarb die Herstellungsrechte für die USA und begann 1949 die Versuchsproduktion einer Faser, die später den Markennamen Dacron erhielt. Sowohl bei der ICI als auch bei Du Pont begann 1953 die Großproduktion der Fasern.
Nach Lizenzvergaben wurden auch in Deutschland Fasern aus Polyethylenterephthalat hergestellt und unter den Markennamen Diolen und später ab 1956 unter dem Firmennamen Trevira auf den Markt gebracht.
Besonders in den 1970er Jahren weitete sich die Produktion dieser Fasern weltweit stark aus. Deren rasche Verbreitung und der damit verbundene wirtschaftliche Erfolg können als einmalig in der Textilbranche betrachtet werden. Fasern aus Polyethylenterephthalat haben die führende Stellung unter den Synthesefasern inne. Das Hauptherstellerland ist in den 2020er Jahren die Volksrepublik China.
Eigenschaften
Physikalische Eigenschaften
PET ist polar, wodurch starke zwischenmolekulare Kräfte vorhanden sind. Das Molekül ist zudem linear ohne Vernetzungen aufgebaut. Beides sind Voraussetzungen für teilkristalline Bereiche und Fasern. Durch diese Bereiche ergibt sich auch eine hohe Bruchfestigkeit und Formbeständigkeit bei einer Temperatur über 80 °C. Die Schlagzähigkeit ist jedoch gering, das Gleit- und Verschleißverhalten gut. Die Glasübergangstemperatur liegt bei etwa 80 °C. In den teilkristallinen Zustand (C-PET) geht PET bei etwa 140 °C über. Die Elementarzelle ist triklin {a = 4,56 nm, b = 5,94 nm, c = 10,75 nm, α = 98,5°, β = 118°, γ = 112°}. Die Dichte von amorphem PET (A-PET) beträgt 1,33–1,35 g·cm−3 und von teilkristallinem C-PET 1,38–1,40 g·cm−3. Im Vergleich zu C-PET besitzt A-PET eine etwas geringere Steifigkeit und Härte, aber eine höhere Schlagzähigkeit.[3] Die Dichte der kristallinen Bereiche ist abhängig von der Dauer und der Temperatur der Festphasenpolykondensation, die zur Erzielung höhermolekularer PET-Güten standardmäßig durchgeführt wird. Der Kristallisationsgrad übersteigt 70 % kaum. Der Schmelzpunkt liegt (abhängig vom Kristallisationsgrad und vom Polymerisationsgrad) zwischen 235 und 260 °C.
Bei starkem Erhitzen zieht sich eine durch Blasen hergestellte Flasche aus PET – ähnlich wie vakuumgezogene Joghurtbecher aus PS – teilweise wieder zusammen.
Chemische Eigenschaften
Polyethylenterephthalate sind gegen viele Chemikalien beständig[10] und werden daher bevorzugt als Behälter für Flüssigkeiten in der Lebensmittelindustrie, aber auch im Labor und in der Medizin verwendet.
Gegenüber starken anorganischen Säuren, insbesondere Schwefelsäure oder Salpeter- und Salzsäure, ist PET jedoch unbeständig.[11]
Die Analyse von PET mittels 1H und 13C NMR-Spektroskopie ist in der Literatur beschrieben.[12]
Herstellung
Die Monomere, aus denen PET hergestellt wird, sind Terephthalsäure (1,4-Benzoldicarbonsäure) und Ethylenglycol (1,2-Dihydroxyethan, Ethan-1,2-diol, Ethandiol).[13]


Die großtechnische Herstellung erfolgt teilweise noch durch Umesterung von Dimethylterephthalat mit Ethandiol. Da es sich um eine Gleichgewichtsreaktion handelt, wird ein Überschuss von Ethandiol eingesetzt, der durch die Reaktionsführung wieder abdestilliert wird, um das Gleichgewicht günstig zu beeinflussen. Die Schmelzphasenpolykondensation führt nicht (in technisch sinnvollen Zeiträumen) zu ausreichend hohen Molmassen. Darum werden PET-Güten für Flaschen oder Industriegarn (z. B. Diolen, Trevira) im Nachgang über Festphasenpolykondensation (SSP – solid state polycondensation) weiter kondensiert.
Auch Ringöffnungsreaktionen aus Oligomeren sind möglich, wobei kein Kondensat anfällt und schnell hohe Molmassen von mehr als 100.000 g/mol erreicht werden können. Diese Verfahren befinden sich jedoch noch in der Entwicklung.
In neueren Verfahren wird Ethandiol mit Terephthalsäure direkt verestert. Bei der Verarbeitung wird PET in teilkristalliner Form bevorzugt, es kristallisiert jedoch spontan nur sehr langsam, weshalb Nukleierungsmittel für eine rasche Kristallisation zugesetzt werden muss.
In PET finden sich oft Spuren von Antimon(III)-oxid, das bei der Herstellung als Katalysator eingesetzt wird.
Seit ungefähr 2010 ist PET auf dem Markt, bei dem die Ethylenglycolkomponente (ca. 30 % des Produkts) aus nachwachsenden Rohstoffen hergestellt ist.[14] 2017 wurden ca. 1,09 Millionen Tonnen davon produziert, womit es den größten Anteil unter allen (teil-)biobasierten Kunststoffen ausmacht.[15] Mitte 2015 wurde zum ersten Mal eine vollständig aus nachwachsenden Rohstoffen hergestellte PET-Flasche auf der Weltausstellung in Mailand präsentiert.[16] Das Produkt ist nicht marktreif, da sich die Herstellung der Terephthalsäure aus nachwachsenden Rohstoffen nicht durchgesetzt hat.
Verwendung

PET wird hauptsächlich zu Textilfasern, zu Folien und Verpackungen (2012: 14,7 Mio. t, Anteil über 20 %, steigend[17]) eingesetzt.
Die bekannteste Verwendung sind PET-Flaschen, sie werden durch Spritzblasen oder Streckblasen gefertigt. Die Verarbeitung zu Textilfasern ist der mengenmäßig größte Anteil. Weitere Anwendungsbeispiele sind Folien, unter anderem zur Anfertigung von Filmträgerfolie, Overheadfolien oder Kondensatoren. Seit den 1950er Jahren können aus PET sehr dünne Folien hergestellt werden, zum Beispiel unter der Marke Hostaphan®, Mylar®.
Als Textilfaser (Polyester) wird PET eingesetzt, weil es knitterfrei, reißfest und witterungsbeständig ist und nur sehr wenig Wasser aufnimmt. Letzteres prädestiniert Stoff aus PET-Fasern für Sportkleidung, die schnell trocknen muss.
In der Lebensmittelindustrie wird PET zur Verpackung eingesetzt. Es kann amorph verarbeitet werden und ist in dieser Form farblos und durchsichtig mit hoher Lichtdurchlässigkeit. Unbeschichtete PET-Flaschen haben eine unzureichende Gasdichtigkeit, weshalb für empfindliche Getränke oder Lebensmittel wie Fruchtsäfte, Bier, Wein oder Ketchup eine Diffusionsbarriere, meist aus Siliciumdioxid, aufgebracht wird.[18] Diese Schicht wird im Plasmaverfahren entweder innen[19] oder außen[20] aufgebracht.
Allerdings entsteht bei der Herstellung der PET-Flaschen auch Acetaldehyd, das in geringen Mengen in den Inhalt übergehen und ihn geschmacklich (sensorisch) verändern kann – dies ist besonders bei Mineralwasser ein Problem.[21] Auch das bei der Herstellung oft verwendete Antimon(III)-oxid (Antimontrioxid) kann sich im Flüssigkeitsinhalt einer PET-Flasche lösen. Untersuchungen von in PET-Flaschen abgefüllten Fruchtsäften ergaben Antimontrioxidkonzentrationen von <1 bis zu 44,7 µg/L in unverdünnten Saftkonzentraten.[22] Der anzuwendende Grenzwert (sog. spezifische Migrationsgrenze) für den Übergang von Antimontrioxid aus Kunststoff in Lebensmittel beträgt 40 µg/L.[23] Dieser Wert wurde bei Fertigbackprodukten teilweise überschritten, dies insbesondere, weil Antimontrioxid bei hoher Temperatur leichter löslich ist.
Wegen seiner guten Gewebeverträglichkeit wird PET auch als Werkstoff für Gefäßprothesen genutzt.
Polyesterfolie
Ein großes Anwendungsgebiet für Polyethylenterephthalat (PET) sind Folien, die in Dicken von 1 bis 800 µm hergestellt werden. Ihre Anwendung geht über Dünnstfolien für Kunststoff-Folienkondensatoren, Prägefolien, Verpackungsfolien für aromadichte Verpackungen, Möbelfolien, eingefärbte Lichtschutzfolien, Kinefilm, Fotofilm, Röntgenfilm, Elektroisolierfolie, Ankernutisolierfolie bis zur Folie für Teststreifen in der pharmazeutischen Industrie. Ein großes Anwendungsgebiet sind auch Trägerfolien für Magnetbänder. Schreibmaschinenbänder wurden ebenfalls aus PET gefertigt.
Hergestellt wird PET-Folie aus einem Rohstoffgranulat, das zuerst getrocknet wird, oder direkt aus der Schmelze (Uhde-Inventa-Fischer-Verfahren). Die Trocknung verhindert den hydrolytischen Abbau bei der Verarbeitung. Durch Aufschmelzen mittels Extrusion und Filtration wird über eine Breitschlitzdüse daraus eine Folie hergestellt. Der flüssige Schmelzefilm wird mittels elektrostatischem Pinning auf eine Gießwalze gepresst und unter die Glasübergangstemperatur von PET, die bei ca. 65 bis 80 °C liegt, abgekühlt. Das elektrostatische Pinning ist eine Anlegemethode für den flüssigen Schmelzefilm, bei dem z. B. ein unisolierter Draht im Millimeterabstand parallel zum Schmelzefilm angebracht wird. An den Draht wird eine Hochspannung von 5 bis 10 kV angelegt. Durch den Dipolcharakter der PET-Moleküle wird die dem Draht zugewandte Seite der Folie positiv aufgeladen. Der Gegenpol ist die geerdete Gießwalze. Mit diesem Verfahren wird der Schmelzefilm gegen die Gießwalze gepresst, die Luft zwischen PET-Film und der gekühlten Gießwalze wird verdrängt. Das ist wichtig für eine rasche gleichmäßige Abkühlung des Films. In diesem Verfahrensschritt entsteht die sogenannte Vorfolie.
Ihre endgültigen mechanischen Eigenschaften erhält die Folie durch den nachfolgenden Streckprozess. Die Streckung erfolgt meist in zwei Schritten, und zwar zuerst in Längs- und danach in Querrichtung. Für die Streckung muss die Folie wieder über die Glastemperatur erwärmt werden. Zur Längsstreckung wird die Folie über geheizte Walzen geführt, aufgewärmt bis zur Strecktemperatur von z. B. 85 °C erwärmt und in einem Streckspalt mit einem zusätzlichen IR-Strahler in Längsrichtung um das 2,5- bis 3,5-fache gedehnt. Die Walzen nach dem Streckspalt drehen sich mit entsprechend höherer Geschwindigkeit.
Der zweite Schritt ist die Breitstreckung. Diese erfolgt in einem Breitstreckrahmen, bei dem die Folie an den Seitenrändern von Kluppenketten gehalten wird. Kluppenketten laufen parallel zur Folienbahn. An den einzelnen Kettengliedern sind Halteklammern zum Fassen der Folienränder angebracht. Zuerst wird die Folie mit heißer Luft aufgewärmt und danach in die Breite gestreckt. Die Ketten werden an einer Führungsschiene so geführt, dass nach dem Vorheizen der Abstand zwischen den Kluppenketten um das 2,5- bis 4-fache verbreitert wird. Der letzte Verfahrensschritt ist die thermische Fixierung der Folie. Die noch in der Kluppenkette eingespannte Folie wird auf eine Temperatur zwischen 200 und 230 °C erhitzt. Dabei werden Spannungen in der Folie abgebaut. Durch die Thermofixierung liegen die Molekülfäden so dicht beieinander, dass infolge des geringen Abstandes eine physikalische Verbindung zwischen den Molekülketten entsteht. Das ist die Kristallitbildung.
Neben diesem Standardprozess gibt es verschiedene Varianten, um besondere Eigenschaften wie erhöhte Festigkeiten in Längsrichtung zu erzeugen.
Soll die Folie später bei hohen Temperaturen (>80 °C) eingesetzt werden und maßhaltig bleiben, so empfiehlt es sich, diese Folien in einem Ofen oberhalb der späteren Einsatztemperatur vorzuschrumpfen, um sie spannungsfrei zu machen. Bei diesem Prozess verändern sich die Maße der Folie entsprechend ihrem Herstellungsprozess. Manche Hersteller bieten deshalb auch vorgeschrumpfte Folien für Hochtemperaturanwendungen an.

Je nach gewünschter Anwendung werden dem Rohstoff noch Pigmente zugesetzt. Dadurch werden die Wickeleigenschaften der fertigen Folie verbessert. Auch zum Mattieren für Möbelfolie werden solche Folien pigmentiert. Auch farbige Pigmente werden eingesetzt. Andere, auch lösliche Zusätze gibt es zur UV-Stabilisierung und -Absorption oder auch zum Färben.
Der Rohstoff kann auch durch andere Polymerbausteine modifiziert werden. Ersetzt man einen Teil der Terephthalsäure durch Isophthalsäure, so sinken der Schmelzpunkt des Rohstoffes und die Kristallisationsneigung und es entsteht PETIP. Die lineare Kettenbildung wird gestört. Durch Koextrusion von PET mit PETIP werden siegelfähige Folien hergestellt.
Die fertigen Folien werden oft noch beschichtet oder mit anderen Folien zu Verbunden verklebt. Verbunde sind z. B. aromadichte Folien für die Kaffeeverpackung.
Metallisiertes Polyethylenterephthalat (MPET)
Metallisiertes Polyethylenterephthalat (Abkürzung: MPET) wie beispielsweise biaxial orientiertes PET (boPET, Mylar) wird für Rettungsdecken verwendet und wurde als Flammhemmer eingesetzt.[24] Seine unzureichende Feuerfestigkeit wurde als eine der Ursachen des schweren Flugunglücks des Swissair-Flugs 111 am 2. September 1998 identifiziert.
Recycling

Aktuelle Verfahren
PET hat den Recycling-Code 01. Der hohe Wert von PET und die Wirtschaftlichkeit des Recyclings lässt sich auch daran erkennen, dass dafür High-Tech-Sortierverfahren mithilfe der Hochgeschwindigkeits-Laserspektroskopie entwickelt wurden. Sie sortieren die Bruchstücke kleingeschredderter PET-Flaschen, die neben dem Hauptbestandteil PET auch andere Kunststoffe (Folienschicht in der Wand, Deckel) enthalten, sortenrein für die Wiederverwertung in Lebensmittelqualität.[25] Das Verfahren war 2010 für den Deutschen Zukunftspreis nominiert.[26] Eine Tonne sortenreines PET hat einen Marktpreis zwischen 400 und 500 Euro (Stand 07/2014).[27]
Im Jahr 2009 wurden europaweit 48,4 % aller PET-Flaschen für das Recycling gesammelt. 40 % des recycelten PET wurde zu Textilfasern verarbeitet, 27 % zu Folien und thermogeformten Produkten, aus 22 % wurden neue Flaschen und Behälter hergestellt und 7 % dienten zur Herstellung von Kunststoffumreifungsbändern.[28]
Forschung
Neuere Forschungen eröffnen Perspektiven, Polyethylenterephthalat in zukünftigen Recycling-Verfahren durch bakterielle Zersetzung von Kunststoff abzubauen. Nach im März 2016 veröffentlichten Forschungsergebnissen wird Polyethylenterephthalat durch das Bakterium Ideonella sakaiensis 201-F6 in zwei Stoffe (Terephthalsäure und Ethylenglycol) zersetzt, was als Basis für ein besseres Recycling dienen könne.[29][30]
Die französische Firma Carbios hat ein Verfahren zur enzymatischen Depolymerisierung von PET-Produkten incl. Textilien mittels bakterieller Enzyme entwickelt. Dabei werden PET-Monomere gewonnen, die sich zu komplett neuwertigen Produkten verarbeiten lassen.[31][32] Eine Demonstrationsanlage arbeitet seit September 2021, verschiedene Hersteller haben mit dem gewonnenen Material bereits Verpackungen hergestellt.[33]
Copolymere
PETG
PETG ist ein mit Glycol modifiziertes PET, welches sich durch seine wässrigen Eigenschaften (Viskosität) auszeichnet. Anwendungen finden sich im Spritzguss und im FDM-3D-Druck.[34]
PEIT
PEIT (Polyethylen-co-isosorbid-terephtalat) ist ein Copolymerisat, bei dem Isosorbid als Comonomer genutzt wird. Das Produkt besitzt Anwendungen im Hochtemperaturbereich und kann für heiß beladene Container und optische Datenspeicher benutzt werden.[35]
Lebensmittelsicherheit
Eine Stellungnahme in der Fachzeitschrift Environmental Health Perspectives vom April 2010 legt nahe, dass PET in üblichen Verwendungsformen sog. Endokrine Disruptoren freisetzen könnte. Der Beitrag empfiehlt weitergehende Erforschung des Werkstoffs.[36]
Das dem PET als Katalysator zugesetzte Antimon kann aus dem Kunststoff austreten. Laut einem Artikel, der in der Fachzeitschrift Journal of Environmental Monitoring im April 2012 veröffentlicht wurde, lag die Konzentration von Antimon in demineralisiertem Wasser, das 48h bei bis zu 60 °C in PET-Flaschen gelagert wurde, unterhalb der Europäischen Grenzwerte. Von 47 frischen Getränke-Proben überschritt lediglich eine den EU-Grenzwert.[37]
In einer Studie wurde die Migration oder Elution von Phthalsäureestern aus Polyethylenterephthalat-Flaschen für Softdrinks gemessen. Die höchsten Werte enthielten Getränke, die mit Kaliumsorbat konserviert waren oder die den geringsten pH-Wert aufwiesen. Die gemessenen Werte waren kein Risiko für die Gesundheit, durch Akkumulation könnten sich aber auch geringe Mengen mit der Zeit anreichern.[38]
Das Bundesinstitut für Risikobewertung stellt fest, dass für die Herstellung von PET-Getränkeflaschen kein Bisphenol A verwendet wird. Der Übertritt von Antimon sei mit gemessenen Konzentrationen von bis zu 2 µg pro Liter weit unter dem Grenzwert von 40 µg pro Liter, der in der EU für den Übertritt in Lebensmittel festgelegt ist. Weiterhin wurden in Getränken aus PET-Flaschen nicht mehr hormonähnliche Substanzen gefunden als in solchen aus Glasflaschen. Es wird darauf hingewiesen, dass Verunreinigungen mit Acetaldehyd zwar unbedenklich seien, die damit manchmal verbundenen geschmacklichen Beeinträchtigungen jedoch nicht hingenommen werden müssten.[39]
Einzelnachweise
- Eintrag zu POLYETHYLENE TEREPHTHALATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. Dezember 2021.
- Eintrag zu Polyethylenterephthalat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. Juli 2017. (JavaScript erforderlich)
- Eintrag zu Polyethylenterephthalate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 16. Januar 2014.
- Mitsubishi Polyester Film GmbH, Datenvergleich für Kunststoff-Folien (Aufgerufen am 24. Juli 2016).
- Polyethylenterephthalat (PET). In: kunststoffe.de. Abgerufen am 2. November 2018.
- Technisches Datenblatt PET (PDF; 143 kB) bei PolyQuick, abgerufen am 2. April 2013.
- „Wasser statt Säure“, Beitrag des Deutschlandfunks vom 17. September 2008 in der Rubrik „Forschung aktuell“.
- Shalini Saxena: Newly identified bacteria cleans up common plastic. In: Ars Technica. 19. März 2016 (arstechnica.com).
- Patent GB578079A: Improvements relating to the manufacture of highly polymeric substances. Angemeldet am 29. Juli 1941, veröffentlicht am 14. Juni 1946, Erfinder: John Rex Whinfield, James Tennant Dickson.
- Römpp Lexikon Chemie, 9. Auflage 1992, Seite 3566
- Kuhnke technologies: Chemische Beständigkeit von Kunststoffen, vom 29. Juli 2003, abgerufen am 9. März 2014.
- Antxon Martínez de Ilarduya, Sebastián Muñoz-Guerra: Chemical Structure and Microstructure of Poly(alkylene terephthalate)s, their Copolyesters, and their Blends as Studied by NMR. In: Macromolecular Chemistry and Physics. 215. Jahrgang, Nr. 22, 1. November 2014, S. 2138–2160, doi:10.1002/macp.201400239 (englisch).
- Sebastian Kotzenburg, Michael Maskus, Oskar Nuyken: Polymere – Synthese, Eigenschaften und Anwendungen. Springer Spektrum, 2014, ISBN 978-3-642-34772-6, S. 195–196.
- Michael Thielen: Biokunststoffe. Fachagentur nachwachsende Rohstoffe e. V. (FNR), 2019, abgerufen am 20. September 2019.
- Institute for bioplastics and biocomposites: Biopolymers – Facts and statistics – Production capacities, processing routes, feedstock, land and water use. (PDF) 2018, abgerufen am 20. September 2019.
- Christian Bonten: Kunststofftechnik: Einführung und Grundlagen. 2. aktualisierte Auflage. Hanser Verlag, 2016, ISBN 978-3-446-44917-6, S. 475.
- Frank Welle: Polyethylenterephthalat (PET), Vom Markt zum Produkt, Zeitschrift Kunststoffe Heft 10/2013, abgerufen am 10. April 2022.
- Julia Weiler: Plasmabeschichtung: So gelangen weniger Gase durch die Kunststoffschicht – Ein Hauch von Glas macht dicht. In: medizin-und-technik.de. 12. Februar 2015, archiviert vom am 30. August 2016; abgerufen am 14. März 2024.
- Plasma-Innenbeschichtung von PET-Flaschen. In: hessen-nanotech.de. 30. August 2016, abgerufen am 30. August 2016.
- Kunststoffflaschen halten dicht: aif.de. In: aif.de. 19. August 2016, abgerufen am 30. August 2016.
- Mineralwasser-Test der Stiftung Warentest, test 8/2008.
- Claus Hansen, Alexandra Tsirigotaki, Søren Alex Bak, Spiros A. Pergantis, Stefan Stürup, Bente Gammelgaard, Helle Rüsz Hansen: Elevated antimony concentrations in commercial juices. In: Journal of Environmental Monitoring. Band 12, Nr. 4, 2010, S. 822–824, doi:10.1039/B926551A.
- Richtlinie 2002/72/EG der Kommission über Materialien und Gegenstände aus Kunststoff, die dazu bestimmt sind, mit Lebensmitteln in Berührung zu kommen in der konsolidierten Fassung vom 9. November 2009, abgerufen am 11. Februar 2017.
- FAA: Airworthiness Directive (englisch)
- unisensor.de: Produkte: PowerSort 200
- Deutscher Zukunftspreis: Laserlicht findet Wertstoffe – Ressourcen für unsere Zukunft (Memento vom 14. September 2013 im Internet Archive).
- Jan Garvert, Wer profitiert von der Wertstofftonne? (Memento vom 14. Juli 2014 im Internet Archive), tagesschau.de vom 11. Juli 2014.
- KRONES magazin, 03/2012, S. 16.
- Müll: Forscher entdecken Plastik-fressende Bakterien. Spiegel online, 11. März 2016, abgerufen am 13. März 2016.
- A bacterium that degrades and assimilates poly(ethylene terephthalate). Science, 11. März 2016, abgerufen am 13. März 2016 (englisch).
- Mutiertes Enzym zerlegt Plastik in Rekordzeit – ingenieur.de. 16. April 2020, abgerufen am 6. Januar 2022.
- PET-Recycling: Mutiertes Enzym von Carbios verdaut Plastikflaschen auf die Schnelle. In: CleanThinking.de. 15. April 2020, abgerufen am 6. Januar 2022.
- History. In: Carbios. Abgerufen am 6. Januar 2022 (französisch).
- Extrudr, Wieso PETG (Memento des vom 25. September 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis., Stand: 20. Sept. 2015.
- Daan S. van Es, Frits van der Klis, Rutger J. I. Knoop, Karin Molenveld, Lolke Sijtsma, and Jacco van Haveren: Other Polyesters from Biomass Derived Monomers. In: Stephan Kabasaci (Hrsg.): Bio-Based Plastics Materials and Applications. Wiley, 2014, ISBN 978-1-119-99400-8, Kap. 9, S. 241–274.
- Leonard Sax: Polyethylene terephthalate may yield endocrine disruptors. In: Environmental Health Perspectives. Band 118, Nr. 4, April 2010, S. 445–448, doi:10.1289/ehp.0901253, PMID 20368129, PMC 2854718 (freier Volltext).
- Aminu Tukur, Liz Sharp, Ben Stern, Chedly Tizaoui, Hadj Benkreira: PET bottle use patterns and antimony migration into bottled water and soft drinks: the case of British and Nigerian bottles. In: Journal of Environmental Monitoring. Band 14, Nr. 4, 1. April 2012, doi:10.1039/c2em10917d.
- Jasna Bošnir, Dinko Puntarić, Antonija Galić, Ivo Škes, Tomislav Dijanić, Maja Klarić, Matijana Grgić, Mario Čurković, Zdenko Šmit: Migration of Phthalates from Plastic Containers into Soft Drinks and Mineral Water; Food Technology and Biotechnology, Vol. 45 No. 1, 2007 (Zusammenfassung); (PDF-Datei, vollständiger Artikel)
- Fragen und Antworten zu PET-Flaschen, FAQ des BfR vom 16. Juli 2020, abgerufen am 12. Sep. 2020
Literatur
- J. R. Whinfield: The Development of Terylene. In: Textile Research Journal. Band 23, Nr. 5, 1953, S. 289–293, doi:10.1177/004051755302300503.
- Derek Moorhouse: Polyester: 50 years of achievement. In: Journal of the Society of Dyers and Colourists. Band 109, Nr. 7–8, 1993, S. 255–255, doi:10.1111/j.1478-4408.1993.tb01570.x.
- H. Vogler: The short but very successful history of polyester fibers. In: Chemical Fibers International. Band 50, 2000, S. 134–143.