Nitrophenole
Die Nitrophenole bilden in der Chemie eine Stoffgruppe, die sich sowohl vom Phenol als auch vom Nitrobenzol ableitet. Die Struktur besteht aus einem Benzolring mit angefügter Hydroxy- (–OH) und Nitrogruppe (–NO2) als Substituenten. Durch deren unterschiedliche Anordnung ergeben sich drei Konstitutionsisomere mit der Summenformel C6H5NO3. Sie sind zumeist durch Nitrierung von Phenol mit (konzentrierter) Salpetersäure zugänglich. Sie fallen unter anderem durch ihre gelbe Farbe auf.
| Nitrophenole | ||||||||
| Name | 2-Nitrophenol | 3-Nitrophenol | 4-Nitrophenol | |||||
| Andere Namen | o-Nitrophenol, 1-Hydroxy-2-nitrobenzol |
m-Nitrophenol, 1-Hydroxy-3-nitrobenzol |
p-Nitrophenol, 1-Hydroxy-4-nitrobenzol | |||||
| Strukturformel | 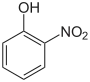 |
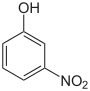 |
||||||
| CAS-Nummer | 88-75-5 | 554-84-7 | 100-02-7 | |||||
| PubChem | 6947 | 11137 | 980 | |||||
| Summenformel | C6H5NO3 | |||||||
| Molare Masse | 139,11 g·mol−1 | |||||||
| Aggregatzustand | fest | |||||||
| Kurzbeschreibung |
gelbliche Nadeln oder Prismen[1] |
farblose Kristalle[2] |
farblose Kristallnadeln[3] | |||||
| Schmelzpunkt | 44 °C[1] | 97 °C[2] | 113–115 °C[3] | |||||
| Siedepunkt | 214 °C[1] | 194 °C (93 mbar)[2] | Zers.[3] | |||||
| pKs-Wert[4] | 7,21 | 8,38 | 7,16 | |||||
| Löslichkeit | 2,1 g/l (20 °C)[1] | 13,5 g/l (25 °C)[2] | 14,8 g/l (25 °C)[3] | |||||
| schwerlöslich in Wasser, löslich in Ethanol, Ether und Chloroform | ||||||||
| GHS- Kennzeichnung |
|
|
| |||||
| H- und P-Sätze | 302‐312‐332‐410 | 302‐319 | 301‐312‐332‐373 | |||||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | ||||||
| 273‐280‐302+352 304+340‐305+351+338‐312 |
305+351+338 | 261‐301+310‐330 302+352‐304+340‐312 | ||||||
Darstellung
2- und 4-Nitrophenol entstehen im Gemisch bei der Nitrierung von Phenol mit verdünnter Salpetersäure. Der −I-Effekt und der +M-Effekt der Hydroxygruppe des Phenols wirken bei der Zweitsubstitution ortho-para-dirigierend. Die Trennung gelingt mittels Wasserdampfdestillation, wobei nur das o-Nitrophenol übergeht.[5] Neue Trennungsmethoden beruhen auf der Tatsache, dass nur o-Nitrophenol in n-Pentan löslich ist.[6]

Beide Isomere können zu 2,4-Dinitrophenol und zu Pikrinsäure weiternitriert werden.
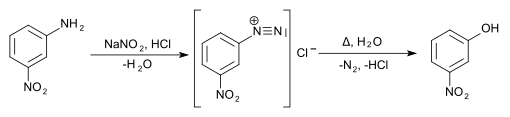
Die Darstellung von 3-Nitrophenol gelingt in zwei Stufen, zunächst durch Halogenierung (z. B. Cl2/AlCl3) von Nitrobenzol (meta-dirigierend); anschließend erfolgt in einer nukleophilen aromatischen Substitution der Tausch des Halogenatoms durch OH:

Ein weiterer Weg läuft über die Diazotierung von 3-Nitroanilin und anschließendes Verkochen des Diazoniumsalzes.
Eigenschaften
Nitrophenole sind kristalline Feststoffe; sie sind schwerlöslich in Wasser, löslich in Ethanol, Ether und Chloroform. 4-Nitrophenol hat einen schwach phenolartigen Geruch.
pKs-Werte
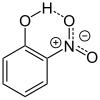
Der schwach saure Charakter des Phenols ist durch die Mesomeriestabilisierung des Phenolat-Ions zu begründen. Die Nitrogruppen wirken elektronenziehend; die phenolische OH-Bindung wird zunehmend polarisiert. 2- und 4-Nitrophenol besitzen gegenüber dem 3-Nitrophenol einen niedrigeren pKs-Wert; damit sind deren Aciditäten größer. Bei der ortho- und para-Form kann das Phenolat-Ion eine Doppelbindung auf die elektronenziehende Nitrogruppe (−M-Effekt) verschieben. Das zweite O kann dort einen negativen Ladungsschwerpunkt ausbilden. Bei der meta-Form ist das nicht möglich.
Schmelzpunkte
Die Schmelzpunkte zeigen deutliche Unterschiede. Das 2-Nitrophenol besitzt den niedrigsten Schmelzpunkt, da es eine intramolekulare Wasserstoffbrücke ausbilden kann. Die beiden anderen Isomere bilden im Gegensatz dazu intermolekulare Wasserstoffbrücken aus. Beim 2-Nitrophenol ist Energie zum Aufbrechen dieser Brücken nicht erforderlich. Das 4-Nitrophenol besitzt aufgrund seiner Symmetrie den höchsten Schmelzpunkt.
Löslichkeit in Wasser
Die Nitrophenole sind in Wasser schwerlöslich, die Werte unterscheiden sich aber innerhalb dieser Gruppe. Die deutlich schlechtere Löslichkeit des 2-Nitrophenols in Wasser lässt sich ebenfalls mit der intramolekularen Wasserstoffbrücke gut erklären. Das Molekül ist dadurch nach außen hin deutlich unpolarer. Dagegen sind die Löslichkeiten des 3- und 4-Nitrophenols etwa gleich und im Vergleich deutlich besser. Hier bilden sich nun zwischen der phenolischen Hydroxygruppe und Wasser eher intermolekulare Wasserstoffbrücken.
Nachweis
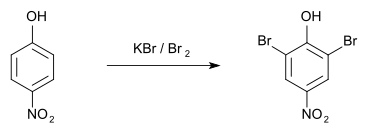
Zum qualitativ-analytischen Nachweis entsteht bei der Bromierung mit Kaliumbromid und Brom beim 2-Nitrophenol das 4,6-Dibromderivat,[7] das einen Schmelzpunkt von 117 °C hat.[8] Beim 4-Nitrophenol entsteht das 2,6-Dibromderivat mit einem Schmelzpunkt von 142 °C.[9] 3-Nitrophenol wird mit KBr/Br2 ebenfalls zweifach bromiert, das Produkt schmilzt bei 91 °C.[10]

Verwendung
Nitrophenole fallen in der chemischen, pharmazeutischen und Rüstungsindustrie als Zwischenprodukte bei der Produktion von Farben, Leder, Gummi, Pestiziden, Fungiziden, Schädlingsbekämpfungsmitteln und Munition an.
Sicherheitshinweise
Nitrophenole sind giftig beim Einatmen, Verschlucken und Kontakt mit der Haut. Es können Reizungen der Augen, der Verdauungswege, Blutvergiftung, Leberschaden, Schwindel, Übelkeit, Kopfschmerz und Atemwegsreizung auftreten. Möglicherweise wirken sie krebserregend und sensibilisierend. In Verbindung mit Alkohol wird die Wirkung verstärkt. Bei Berührung mit der Haut sollte sofort mit viel Wasser abgewaschen werden. Sie haben giftige Wirkung auf das Nervensystem von Lebewesen.
Ein großes Problem stellt die Entfernung von Nitrophenolen und verwandten Verbindungen aus dem Grundwasser dar. Solche Kontaminationen sind mitunter in ehemaligen Sprengstoff- oder Farbenfabriken und militärischen Anlagen zu finden. Eine neue Entwicklung zur vollständigen Entfernung von Nitrophenolen aus Grundwasser ist ein Katalysator, der aus Eisen mit einem Tetra-Amido-Makrocyclischen Liganden (Fe-TAML) besteht und die Oxidation der Gifte durch Wasserstoffperoxid ermöglicht. Dabei fallen keine weiteren giftigen Substanzen an. Der Katalysator wurde an der Carnegie Mellon University entwickelt.[11][12]
Siehe auch
Literatur
- Allinger, Cava, de Jongh, Johnson, Lebel, Stevens: Organische Chemie. Walter de Gruyter, Berlin 1980, ISBN 3-11-004594-X, S. 375–376, 916.
- Streitwieser, Heathcock: Organische Chemie. VCH, Weinheim 1980, ISBN 3-527-25810-8, S. 1056, 1179, 1189–1191.
- Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie. 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 467–468.
- Morrison, Boyd: Lehrbuch der Organischen Chemie. 3. Auflage, VCH, Weinheim 1986, ISBN 3-527-26067-6, S. 1074–1076, 1121–1122.
Einzelnachweise
- Eintrag zu 2-Nitrophenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. März 2017. (JavaScript erforderlich)
- Eintrag zu 3-Nitrophenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. März 2017. (JavaScript erforderlich)
- Eintrag zu 4-Nitrophenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. März 2017. (JavaScript erforderlich)
- CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- Versuchsvorschrift: Nitrierung von Phenol zu 2-Nitrophenol und 4-Nitrophenol (PDF) der Sammlung Integriertes Organisch-chemisches Praktikum der Universität Regensburg, abgerufen am 30. Oktober 2011.
- A. Khazaei, M. A. Zolfigol, A. R. Moosavi-Zare, A. Zare: An Efficient Method for the Nitration of Phenols with NaNO2 in the Presence of 3-Methyl-1-Sulfonic Acid Imidazolium Chloride. In: Scientia Iranica. Band 17, Nr. 1, 2010, S. 31–36 (PDF – freier Volltext).
- Heinz G. O. Becker (Hrsg.): Organikum. 19. Auflage. Johann Ambrosius Barth, Deutscher Verlag der Wissenschaften, Leipzig / Berlin / Heidelberg 1993, ISBN 3-335-00343-8, S. 331.
- F. Wild: Characterisation of Organic Compounds. CUP Archive, Cambridge 1947, S. 84 (eingeschränkte Vorschau in der Google-Buchsuche).
- F. Wild: Characterisation of Organic Compounds. CUP Archive, Cambridge 1947, S. 86 (eingeschränkte Vorschau in der Google-Buchsuche).
- Heinz G. O. Becker (Hrsg.): Organikum. 19. Auflage. Johann Ambrosius Barth, Deutscher Verlag der Wissenschaften, Leipzig / Berlin / Heidelberg 1993, ISBN 3-335-00343-8, S. 653.
- Katalysator baut Nitrophenol ab. (Memento vom 1. Dezember 2016 im Internet Archive) In: Welt online. 30. August 2005.
- Soumen Kundu, Arani Chanda, Jasper V. K. Thompson, George Diabes, Sushil K. Khetan, Alexander D. Ryabov, Terrence J. Collins: Rapid degradation of oxidation resistant nitrophenols by TAML activator and H2O2. In: Catalysis Science & Technology. Band 5, Nr. 3, 2015, S. 1775–1782, doi:10.1039/C4CY01426J.



