Ozonabbau
Als Ozonabbau wird die Zerstörung des Ozons in der Stratosphäre durch photochemische und katalytische Prozesse bezeichnet. Anthropogene Emissionen halogenierter Substanzen, die für Kühl-, Klima- und Wärmepumpensysteme verwendet werden, sowie die Emission von Distickstoffmonoxid haben zu einem Anstieg der Konzentration ozonabbauender Radikale in der Stratosphäre und dadurch zu einem Anstieg des Ozonabbaus im Verhältnis zur Ozonbildung geführt. Der stratosphärische Ozonabbau durch Spurengase aus anthropogenen Quellen ist eines der globalen Umweltprobleme des 21. Jahrhunderts.

Neben dem natürlichen Abbau im Ozon-Sauerstoff-Zyklus wird Ozon katalytisch durch Radikale wie das Hydroxyl-Radikal, Stickstoffmonoxid sowie atomares Chlor, Brom und Iod abgebaut. Letztere werden photolytisch aus halogenorganischen Verbindungen wie Fluorchlorkohlenwasserstoffen (FCKW) sowie bromierten und iodierten Kohlenwasserstoffen technischen oder natürlichen Ursprungs freigesetzt. Die Nettoreaktion dieser radikalinduzierten Katalysezyklen ist die Rekombination von Sauerstoffatomen mit Ozon zu molekularem Sauerstoff.
Der Ozonabbau wird zusätzlich zur chemischen Zusammensetzung der Stratosphäre und der Strahlungsleistung der Sonne von einer Vielzahl von Klimafaktoren und atmosphärischen Transportprozessen beeinflusst. Vulkanausbrüche, große Waldbrände und die Emission sehr kurzlebiger halogenorganischer Substanzen natürlichen Ursprungs beeinflussen ebenfalls den stratosphärischen Ozonabbau. Der durch Vulkanausbrüche mögliche Abbau der Ozonschicht wird neben anderen dadurch verursachten Umweltbelastungen mit früheren Massenaussterben in der Erdgeschichte in Verbindung gebracht.
Neben einer generellen Abnahme der Gesamtmenge an Ozon in der weltweiten Ozonschicht seit den 1970er Jahren findet seitdem auch ein starker Ozonabbau während des antarktischen Frühlings von August bis Anfang Dezember über dem Südpol statt. Dieser Abbau ist als Ozonloch bekannt, wobei die Ozonkonzentration innerhalb weniger Wochen dramatisch abnimmt. Der Ozonabbau erreicht dort seinen Höhepunkt Anfang Oktober und endet im späten Frühling oder frühen antarktischen Sommer. Nachdem es bereits in den 1970er Jahren Hinweise auf das Problem des Ozonabbaus gab, wurde 1985 das Ozonloch von Forschern des britischen Polarforschungsprogramms British Antarctic Survey, das ein Netz von Forschungsstationen in der Antarktis unterhält, erstmals weltweit publik gemacht. Besondere meteorologische Bedingungen wie der Einschluss der polaren Luftmassen im Auge des Polarwirbels über dem Südpol und die Bildung von polaren Stratosphärenwolken begünstigen den starken Ozonabbau. Der Ozonabbau in der Arktis ist meist weit weniger ausgeprägt als in der Antarktis. Anhaltende kalte Polarwirbel können jedoch auch in der Arktis einen Ozonabbau ermöglichen, der demjenigen in der Antarktis gleicht.
Der Ozonabbau und die Wechselwirkungen zwischen der stratosphärischen Ozonschicht und der ultravioletten Strahlung der Sonne haben vielfältige Auswirkungen auf die menschliche Gesundheit sowie auf terrestrische und aquatische Ökosysteme, da eine ausgedünnte Ozonschicht mehr UV-B-Strahlung zum Erdboden durchlässt. Dies hat weltweit Besorgnis über ein erhöhtes Hautkrebsrisiko, die Schwächung des menschlichen Immunsystems und die Schädigung der Ökosysteme ausgelöst.
Diese Bedenken führten 1987 zur Verabschiedung des Montreal-Protokolls, eines internationalen Abkommens zum Schutz der Ozonschicht durch den schrittweisen Ausstieg aus der Produktion und Verwendung einer Reihe von ozonabbauenden Substanzen, das am 1. Januar 1989 in Kraft trat. Seither wurde es mehrfach überarbeitet. Mit der Kigali-Änderung des Montreal-Protokolls im Jahr 2016 wurde der Ausstieg aus der Produktion von Fluorkohlenwasserstoffen beschlossen, die zwar nicht ozonabbauend sind, jedoch als starke und langlebige Treibhausgase zum Klimawandel beitragen. Dank des Erfolgs des Montreal-Protokolls und seiner Änderungen und Anpassungen ist die Belastung der Erdatmosphäre mit anthropogenen Halogenen, die in den 1990er Jahren ihren Höhepunkt erreicht hatte, seither langsam zurückgegangen.
Wirkung und Verteilung des atmosphärischen Ozons


Ozon ist ein natürlicher Bestandteil der Atmosphäre, ein Spurengas, das in den verschiedenen Schichten der Atmosphäre auf unterschiedliche Weise wirkt und verteilt ist. Seine Säulenhöhe beträgt im Mittel etwa 350 Dobson-Einheiten, entsprechend 0,035 Meter unter Standardbedingungen. Im Vergleich dazu beträgt die Säulenhöhe der gesamten Atmosphäre unter Standardbedingungen etwa 8031 Meter, die Säulenhöhe des Edelgases Argon 74 Meter und die von Kohlenstoffdioxid 2,5 Meter. Dies zeigt, wie gering die atmosphärische Ozonmenge ist und wie groß die damit verbundene Empfindlichkeit der Ozonschicht.[3]
Die Lebensdauer des Ozons in der sonnenbestrahlten Atmosphäre in etwa 35 bis 70 Kilometern Höhe beträgt weniger als einen Tag und ist damit klein im Vergleich zur Zeitskala, in der atmosphärische Transportprozesse in dieser Höhe ablaufen. Die Ozonchemie wird dort überwiegend durch photochemische Prozesse bestimmt und nicht durch Transportprozesse. Beim Durchgang durch die Atmosphäre schwächt sich die Sonnenstrahlung ab, so dass in immer geringeren Höhen immer weniger Sonnenstrahlung für photochemische Reaktionen zur Verfügung steht. Dadurch verlängert sich die Ozonlebensdauer unterhalb von etwa 25 Kilometern auf Monate bis Jahre und neben den photochemischen Prozessen bestimmen Transportprozesse den Ozonhaushalt in der unteren Stratosphäre.[4]
Etwa 10 % des gesamten atmosphärischen Ozons befinden sich in der Troposphäre und 90 % in der Stratosphäre, wobei der größte Teil, die Ozonschicht, sich in einer Höhe von etwa 15 bis 30 Kilometern befindet.[5] Als bodennahes Ozon ist es schädlich für den Menschen und die terrestrischen Ökosysteme, in der freien Troposphäre erhöht es die Oxidationskapazität und den Schadstoffabbau, in der oberen Troposphäre trägt es zum Treibhauseffekt bei und in der Stratosphäre absorbiert es UV-Strahlung. Neben Feinstaub gilt bodennahes Ozon als ein bedeutender Luftschadstoff, der weltweit für etwa 700.000 Todesfälle pro Jahr verantwortlich ist.[6] Ozon reizt die Schleimhäute und die Augen, beim Einatmen kommt es zu einer Reizung des Lungengewebes, was zu einem verstärkten Hustenreiz und verminderter Leistungsfähigkeit führt.[7]
In Pflanzen bildet es reaktive Sauerstoffspezies wie Wasserstoffperoxid und verringert dadurch die Photosynthese und das Pflanzenwachstum. Aufgrund der schädlichen Auswirkungen von bodennahem Ozon auf das Pflanzenwachstum kommt es zu weltweiten wirtschaftlichen Verlusten, die im Jahr 2012 auf 14 bis 26 Milliarden Dollar geschätzt wurden.[6] In Deutschland liegt das Langfristziel für bodennahes Ozon bei maximal 120 Mikrogramm pro Kubikmeter, gemittelt über ausgewählte Messstationen. Im Zeitraum 2000 bis 2023 wurde dieser Wert an durchschnittlich 19 Tagen pro Jahr überschritten.[8]
In der freien Troposphäre reagiert es mit Wasser zu Hydroxyl-Radikalen. Diese reagieren mit vielen organischen Spurengasen, Stickoxiden und Kohlenstoffmonoxid und tragen damit zum Schadstoffabbau in der freien Troposphäre bei.[9] Troposphärisches Ozon gehört neben Wasserdampf, Kohlenstoffdioxid, Methan, FCKW und Distickstoffoxid zu den relevanten Treibhausgasen. Ozon absorbiert Infrarotstrahlung im Wellenlängenbereich von 9000 bis 10.000 Nanometern. Dies ist ein Spektralbereich, in dem andere Spurengase kaum absorbieren und der nahe am Emissionsmaximum der Erde liegt.[10]
Stratosphärisches Ozon absorbiert den Großteil der UV-B-Strahlung, wodurch sich die Stratosphäre erwärmt und die Erdoberfläche geschützt wird. Die Temperatur in der Troposphäre sinkt auf weniger als -50 °C an der Tropopause, die Absorption der UV-Strahlung in der Stratosphäre durch Ozon führt jedoch zu einer deutlichen Erwärmung von bis zu 0 °C in 50 Kilometern Höhe.[11]
Geschichte
Frühe Arbeiten


Der deutsch-schweizerische Chemiker Christian Friedrich Schönbein gab 1839 die Entdeckung einer neuen Substanz bekannt, die er nach dem griechischen Wort ozein (ὄζειν), „das Riechende“, „Ozon“ nannte. Er hatte bei Versuchen zur Elektrolyse von Wasser einen auffälligen Geruch bemerkt, der ihn auf ein neues Produkt seiner Experimente hinwies. Dabei handelt es sich um ein allotrope Form des Sauerstoffs. Er vermutete, dass Ozon eine bedeutende Rolle in der Atmosphäre als Desinfektionsmittel gegen epidemische Krankheiten spielen könnte und empfahl genaue Messungen des Ozongehalts der Atmosphäre.[12]
„Geneigt zu glauben, das atm. Ozon spiele im Haushalte der Erde eine wichtige Rolle, halte ich es für wünschenswerth, dass möglichst zahlreiche, sowohl grosse Zeiträume als bedeutende Länderstrecken umfassende, untereinander vergleichbare Beobachtungen über die Veränderungen des Ozongehaltes der Atmosphäre angestellt werden.“
Schönbein entwickelte zu diesem Zweck ein „Ozonometer“ aus iodiertem Stärkepapier. Die damit gewonnenen Daten über bodennahes Ozon waren jedoch nur von geringem Wert, da die Methode unspezifisch und von meteorologischen Faktoren wie Windgeschwindigkeit und Luftfeuchtigkeit abhängig war.[12]
Ein weiterer Baustein bei der Erforschung des atmosphärischen Ozons war die Entdeckung des französischen Physikers Alfred Cornu im Jahre 1878, dass das auf der Erdoberfläche messbare Sonnenspektrum unterhalb von 300 Nanometern abbricht. Der irische Chemiker Walter Noel Hartley vermutete 1881 aufgrund spektroskopischer Untersuchungen, dass Ozon für diese Absorption verantwortlich ist. Die entsprechende Absorptionsbande des Ozons im Wellenlängenbereich von 200 bis 300 Nanometern wird ihm zu Ehren „Hartley-Bande“ genannt. Aus seinen Messungen schloss Hartley, dass Ozon ein normaler Bestandteil der Erdatmosphäre ist.[13]

Die Entdeckung der spektroskopischen Eigenschaften des Ozons durch Hartley eröffnete die Möglichkeit, die Gesamtstärke der atmosphärischen Ozonsäule zu messen. Die französischen Physiker Charles Fabry und Henri Buisson konstruierten zu diesem Zweck einen Spektrographen, mit dem sie im Mai und Juni 1920 die Ozonmenge über Marseille bestimmten. Ihren Messungen zufolge betrug die Dicke der Ozonschicht etwa 3 Millimeter unter Standardbedingungen (0 °C, 1 atm). Sie stellten die Hypothese auf, dass Ozon durch die UV-Strahlung der Sonne entsteht und sich dadurch eine Ozonschicht in etwa 50 Kilometern Höhe bildet.[14]
Ein weiterer wichtiger Beitrag zur stratosphärischen Ozonforschung war die Konstruktion von differentiellen optischen Absorptionsspektrometern zur Messung der Ozonschichtdicke durch Gordon Dobson, sogenannte Dobson-Spektrophotometer. Sie ermöglichten regelmäßige Messungen der Gesamtozonsäule über längere Zeiträume.[15] Die Maßeinheit für die Stärke der atmosphärische Ozonsäule, die Dobson-Einheit, ist nach ihm benannt.
Der Geophysiker Paul Götz und andere konnten zeigen, dass es in der unteren Atmosphäre wenig Ozon gibt, indem sie UV-Spektren einer Quecksilberdampflampe über lange Strecken in bodennaher Luft aufnahmen.[16] Die Dicke der Ozonschicht in den bodennahen Luftschichten lag bei Standardbedingungen im Bereich von einigen hundertstel Millimetern pro Kilometer Luftlinie. In dem von ihm gegründeten „Lichtklimatischen Observatorium Arosa“ begann Götz 1926 mit Messungen zur Bestimmung der Gesamtmenge des atmosphärischen Ozons, die als die weltweit längsten ihrer Art gelten.[17] Ein wissenschaftlicher Meilenstein war die vertikale Ozonmessung auf der Basis des von Götz entdeckten Umkehreffekts, der zeigte, dass die maximale Ozonkonzentration in einer Höhe von 20 bis 22 Kilometern vorliegt.[18]
Der britische Geophysiker Sydney Chapman entwickelte 1930 eine photochemische Theorie der Bildung und Zerstörung des stratosphärischen Ozons, den sogenannten Chapman- oder Ozon-Sauerstoff-Zyklus. Die von ihm vorgeschlagenen Auf- und Abbaureaktionen von Sauerstoffmolekülen, Sauerstoffatomen, UV-Licht, Ozon und neutralen Stoßpartnern erklärten die grundlegenden Eigenschaften der beobachteten Ozonverteilung in der Stratosphäre.[19]
Entwicklung der Fluorchlorkohlenwasserstoffe
Ebenfalls 1930 suchte Frigidaire, eine Tochterfirma von General Motors und damals einer der führenden Hersteller von Kühlschränken in den USA, nach einer ungiftigen und nicht brennbaren Alternative zu bestehenden Kältemitteln. Bis Ende der 1920er Jahre wurden Verbindungen wie Ammoniak, Chlormethan, und Schwefeldioxid als Kältemittel in Klima- und Kühlanlagen eingesetzt. Diese waren giftig oder brennbar. Mit der Lösung des Problems wurde Thomas Midgley, ein Mitarbeiter der Forschungsabteilung von General Motors, beauftragt.[20]
Zusammen mit Albert Leon Henne konzentrierte er sich auf die Synthese von Fluorchlorkohlenwasserstoffen, da diese ungiftig und chemisch sehr stabil waren. Der erste Fluorchlorkohlenwasserstoff, der auf den Markt kam, war Dichlordifluormethan, das unter dem Namen „Freon 12“ vermarktet wurde. General Motors und DuPont gründen dazu 1930 die Kinetic Chemical Company zur Herstellung und Vermarktung von Kältemitteln auf Basis von Fluorchlorkohlenwasserstoffen. Für seine Arbeit erhielt Midgley 1937 die Perkin Medal der Society of Chemical Industry. Freon und ähnliche Fluorchlorkohlenwasserstoffe ersetzten bald die bis dahin üblichen Kältemittel.[21]
Bis 1937 besaß jede zweite amerikanische Familie einen Kühlschrank, der FCKW enthielt. Der weltweite Verbrauch von FCKW wie Trichlorfluormethan und Dichlordifluormethan stieg schnell an und betrug 1974 fast eine Million Tonnen. Sie wurden in Klimaanlagen, in Feuerlöschern, zum Aufschäumen von Polystyrol und Polyurethanen und als Lösungsmittel in der Mikroelektronik verwendet. Etwa 70 % dienten als Treibgas in Sprühdosen für Produkte wie Haarspray, Deodorants, Insektizide und andere Anwendungen.[19] Seit ihrer ersten Synthese durch Midgley in den 1930er Jahren bis Anfang der 1970er Jahre erlebten diese Chemikalien einen großen kommerziellen Erfolg, ohne dass ihr Verhalten nach der Freisetzung hinterfragt wurde.[22]
Verbleib der Fluorchlorkohlenwasserstoffe
Erste Hinweise auf die Verteilung der Fluorchlorkohlenwasserstoffe in der Atmosphäre lieferten Luftanalysen, die James Lovelock Anfang der 1970er Jahre mit einem Gaschromatographen und dem von ihm entwickelten Elektroneneinfangdetektor während eines Sommerurlaubs auf der Beara-Halbinsel im Südwesten Irlands durchführte.[23] Er konnte Trichlorfluormethan nachweisen, für das keine natürliche Quelle bekannt ist und dessen wahrscheinlicher Emissionsort weit entfernt von der Messstelle lag. Später wurde dieser Fluorchlorkohlenwasserstoff ebenfalls in Luftproben gefunden, die Lovelock auf einer Forschungsreise mit dem Forschungsschiff R. V. Shackelton des British Antarctic Survey in die Antarktis sammelte. Lovelocks Messungen zeigten, dass einmal freigesetzte Fluorchlorkohlenwasserstoffe in der Atmosphäre verbleiben und durch Transportprozesse über den gesamten Globus verteilt werden.[24]
- Nobelpreisträger für Chemie 1995



Ende der 1960er Jahre setzte eine öffentliche Diskussion über die mögliche Schädigung der Ozonschicht durch eine geplante Luftflotte von in der Stratosphäre fliegenden Überschallflugzeugen ein. Paul J. Crutzen und Harold S. Johnston wiesen nach, dass der Ausstoß von Stickoxiden in der Stratosphäre die Ozonschicht schädigen könnte und die Arbeiten von Richard S. Stolarski und Ralph J. Cicerone zeigten, dass atomares Chlor und Chlormonoxid ähnliche Katalysezyklen wie Stickoxide auslösen und zum Ozonabbau führen können.[25] Über den möglichen Ozonabbau durch Brom und Brommonoxid wurde 1975 von Steven C. Wofsy berichtet.[26]
Frank Sherwood Rowland und Mario J. Molina veröffentlichten 1974 einen Artikel in Nature, in dem sie darauf hinwiesen, dass Fluorchlorkohlenwasserstoffe, die in der unteren Atmosphäre weitgehend inert sind, durch UV-Strahlung in der Stratosphäre atomares Chlor freisetzen und damit die Ozonschicht schädigen können.[27] Diese Veröffentlichungen wurden besonders in den USA viel diskutiert und führten zum Verbot von FCKW in vielen Bereichen.[28] Für „ihre Arbeiten auf dem Gebiet der Atmosphärenchemie, insbesondere der Bildung und des Abbaus von Ozon“, erhielten Crutzen, Rowland und Molina 1995 den Nobelpreis für Chemie.[29]
Entdeckung des Ozonlochs

Erwartet wurde ein langsamer globaler Ozonabbau durch die FCKW von wenigen Prozent, der nach Berechnungen der EPA schon zu erhöhter UV-B-Strahlung und damit zu vermehrten Hautkrebsfällen führen würde. Eine Veröffentlichung von Joe Farman im Jahr 1985 über die unerwartete Entdeckung des fast vollständigen Abbaus des Ozons über dem Südpol im antarktischen Frühling machte das Ozonloch erstmals weltweit bekannt.[30] Als Ozonloch wird eine geographische Region bezeichnet, in der die Gesamt-Ozon-Säule unter einen Wert von 220 Dobson-Einheiten sinkt.[31]
Nachforschungen ergaben, dass die Messgeräte an Bord der Nimbus-Satelliten der NASA die Entwicklung des Ozonabbaus aufgezeichnet hatten und auch das Ozonloch selbst dabei detektierten. Die Instrumentendaten wurden jedoch mit Algorithmen verarbeitet, die die scheinbar zu niedrigen Ozonwerte als Fehlmessungen interpretierten und in der Auswertung ignorierten. Eine erneute Analyse der Rohdaten der Satelliteninstrumente bestätigte im Nachhinein die Entstehung des Ozonlochs.[32] Besonders alarmierend war die Erkenntnis, dass der drastische antarktische Ozonabbau innerhalb weniger Jahre seit Ende der 1970er Jahre stattgefunden hatte.[30]
Die Ursache für den massiven Ozonabbau, der zunächst nur in der Antarktis im dortigen Frühjahr beobachtet wurde, blieb zunächst unklar. Die Atmosphärenchemikerin Susan Solomon vermutete 1986 als Ursache zutreffend die Bildung von Reservoir- oder Speichergasen und deren anschließende Freisetzung in heterogenen Reaktionen an polaren Stratosphärenwolken. Dabei entstehen reaktive Gase, die im antarktischen Frühling durch den Wiederkehr der Sonneneinstrahlung photolysiert werden und zum erheblichen Ozonabbau beitragen.[33] Ihre Entdeckung führte zu umfangreichen Forschungen über heterogene Reaktionen und die Rolle von polaren Stratosphärenwolken und Aerosolen bei der Aktivierung von sogenannten Reservoirgasen, katalytisch inaktiven Speicherformen von Halogenen und Stickoxiden wie Chlorwasserstoff und Chlornitrat.[13] Doch nicht nur in der Antarktis kam es zu einem starken Ozonabbau. In den Jahren 1992 und 1993 zeigten satelliten- und bodengestützte Instrumente weltweit sehr niedrige Gesamtozonwerte, die in Nordamerika, Europa und Sibirien im Mittel 11 bis 13 % unter dem Normalwert lagen.[34]
21. Jahrhundert

Im 21. Jahrhundert wurden große Fortschritte in der Erforschung der polaren Stratosphärenwolken und ihrer Rolle bei heterogenen Reaktionen erzielt. So konnten durch ballongestützte massenspektrometrische Messungen große, schnell sedimentierende Salpetersäuretrihydratpartikel nachgewiesen werden, die zu einer Denitrifizierug der unteren Stratosphäre führen. Mit Lidar-Messungen wurden flüssige Partikel in polaren Stratosphärenwolken nachgewiesen, bei denen es sich um unterkühlte ternäre Lösungen aus Schwefelsäure, Salpetersäure und Wasser handelt. Sowohl die Denitrifizierung als auch die Aktivierung von Reservoirgasen an flüssigen schwefelsäurehaltigen Aerosolen tragen zum polaren Ozonabbau bei.[36]
Durch die fortgesetzte Forschungstätigkeit im Bereich der atmosphärischen Beobachtungen, Laborversuchen und dem Einsatz von numerischen Klima-Chemie-Modellen lassen sich die verschiedenen physikalischen, dynamischen und chemischen Prozesse und deren Rückkopplungen simulieren. Dazu gehören Änderungen der Sonnenaktivität, große Vulkanausbrüche, anthropogene Einflüsse sowie steigende troposphärische Treibhausgaskonzentrationen, die zu einer Abkühlung der Stratosphäre führen. Nach diesen Computersimulationen ist eine vollständige Erholung der Ozonschicht bis zur Mitte des Jahrhunderts zu erwarten, wobei die Modelle bezüglich der vielen Einflussgrößen und den komplexen Wechselwirkungen der atmosphärischen Prozesse mit großen Unsicherheiten behaftet sind.[37]
So kam es außerhalb der Antarktis wiederholt zu einem nicht erwarteten großräumigen Ozonabbau. Im Dezember 2003 wurde im Hochland von Tibet eine Abnahme des Gesamtozons um mehr als 20 % beobachtet, wahrscheinlich verursacht durch den Transport von Luftmassen mit niedrigem Ozongehalt aus den Subtropen und der unteren Troposphäre.[38] Ein ungewöhnlich starker Ozonabbau über der Arktis im Jahr 2004 wurde mit einer erhöhten Sonnenwindaktivität im Oktober 2003 in Verbindung gebracht, bei der energiereiche Elektronen und Protonen in die obere Erdatmosphäre gelangten und dort eine erhöhte Produktion von Stickoxiden verursachten. Durch starke Winde im arktischen Stratosphärenwirbel wurden die gebildeten Stickoxide weiter abwärts transportiert, wo sie ab etwa 40 Kilometern Höhe zum Ozonabbau führten.[39] Im arktischen Stratosphärenwinter 2010/2011, einem der kältesten seit Beginn der Aufzeichnungen, wurde etwa die Hälfte des arktischen Ozons abgebaut. Das Ausmaß des Ozonabbaus war so groß, dass es mit dem Ozonloch, das sich jeden Winter über der Antarktis bildet, vergleichbar war und daher als arktisches Ozonloch bezeichnet wurde.[40]
Politische Maßnahmen
Politische Maßnahmen in den Vereinigten Staaten

Der Ozonabbau wurde Anfang der 1970er Jahre besonders in den USA zu einem umweltpolitischen Thema, als Untersuchungen über eine mögliche Zerstörung des stratosphärischen Ozons durch Emissionen von Überschallflugzeugen begannen. Auslöser der Untersuchungen war die Entwicklung der Concorde durch Frankreich und Großbritannien, die Entwicklung der Tupolew Tu-144 in der Sowjetunion und die Pläne zum Bau der Boeing 2707 in den USA.[41] Das Massachusetts Institute of Technology machte auf den möglichen Ozonabbau durch die Abgasemissionen einer geplanten Flotte von Überschallflugzeugen aufmerksam. Demnach würden die Emissionen der Überschallflugzeuge in der Stratosphäre einen Smog erzeugen, der zum Abbau des Ozons führen könnte. Harold S. Johnston, ein Atmosphärenchemiker und zur damaligen Zeit Associate Professor an der Stanford University, wies nach, dass besonders die Stickoxidemissionen zum Abbau des stratosphärischen Ozons beitragen würden.[42] Die europäischen Länder, insbesondere das Vereinigte Königreich und Frankreich, wo die Concorde entwickelt wurde, zweifelten an der Ernsthaftigkeit der amerikanischen Umweltanliegen. Diese Länder vermuteten eher wirtschaftliche Interessen als Umweltbelange und äußerten ihren Unmut über den „Umweltneokolonialismus“ der USA.[41]
Der Kongress der Vereinigten Staaten beschloss 1971, die Finanzierung der kommerziellen Entwicklung von Überschallflugzeugen aus wirtschaftlichen Gründen und wegen des zu erwartenden Triebwerklärms und des Überschallknalls einzustellen.[41] Weiterhin ermächtigte der Kongress Ende 1971 das Verkehrsministerium der Vereinigten Staaten, die möglichen Umweltauswirkungen von Stratosphärenflügen zu untersuchen. Das Ministerium initiierte daraufhin ein mehrjähriges Forschungsprogramm, um die Auswirkungen des direkten Eintrags von Flugzeugabgasen in die Stratosphäre zu untersuchen. Die Ergebnisse des Programms bestätigten die Theorie, dass Stickoxide, die in die Stratosphäre gelangen, zum Abbau des Ozons beitragen. Die Medien berichteten ausführlich über das Thema. Insbesondere die wachsende Besorgnis, dass eine erhöhte UV-B-Strahlung als Folge des stratosphärischen Ozonabbaus zu einer erhöhten Inzidenz (Zahl der Neuerkrankungen pro 100.000 Menschen in einem Jahr) von Hautkrebs beim Menschen führen könnte, weckte ein großes öffentliches Interesse.[43]

Während der Diskussion um die Auswirkungen von Überschallflügen wurde die Öffentlichkeit durch einen Artikel von Molina und Rowland in Nature und die darauf folgende Berichterstattung über den durch Fluorchlorkohlenwasserstoffe katalysierten Ozonabbau auf die FCKW-Problematik aufmerksam.[27] Damit wurde deutlich, dass freigesetzte FCKW eine reale Bedrohung darstellen, die im Kontext einer wachsenden Besorgnis über Umweltprobleme von Politik und Öffentlichkeit ernst genommen wurde.[41] FCKW wurden unter anderem als Treibmittel in Sprühdosen verwendet, und nun verbreiteten die Medien die Meldung, dass die Verwendung von Produkten wie Haarspray und Deodorants erhebliche Umwelt- und Gesundheitsrisiken mit sich bringen konnte. In einer Folge der beliebten Fernsehserie „All in the Family“ wurde 1975 behauptet, dass FCKW-haltige Haarsprays die Ozonschicht zerstören und alle Menschen töten würden.[19] Die US-amerikanische Umweltschutzorganisation Natural Resources Defense Council reichte Petitionen bei der Food and Drug Administration, der Environmental Protection Agency (EPA) und der Consumer Product Safety Commission ein, um Fluorchlorkohlenwasserstoffe als Treibmittel in Sprühdosen zu verbieten.[28]
In den Medien und bei Anhörungen im Kongress wiesen Molina und Rowland eindringlich auf die Gefahren des Ozonabbaus durch FCKW hin. Zunächst schlugen sie vor, FCKW als Treibmittel in Sprühdosen zu verbieten, da es für diese Anwendung bereits Alternativen gab. Diese Maßnahme war schnell umsetzbar und hätte die Emissionen in den USA um etwa 50 % reduziert.[44] Oregon erlies daraufhin 1975 ein Gesetz zum Verbot von FCKW-Sprühdosen, die Verkäufe von Sprühdosen gingen rapide zurück und S. C. Johnson & Son kündigte an, die Verwendung von FCKW als Treibmittel einzustellen. Im Oktober 1976 wurde in den USA der Toxic Substances Control Act (TSCA, Gesetz zur Überwachung von Gefahrstoffen) verabschiedet, der der Environmental Protection Agency (EPA, Umweltschutzbehörde) weitreichende Kompetenzen zur Regulierung von FCKW einräumte. Darüber hinaus wurde die Behörde 1977 durch eine Änderung des Clean Air Act (CAA, Gesetz zur Reinhaltung der Luft) verpflichtet, alle Aktivitäten zu regulieren, die eine Gefahr für die Stratosphäre und die öffentliche Gesundheit darstellen. Trotz der Ungewissheit über das Ausmaß des Umweltproblems beschloss die EPA 1977, die Verwendung von FCKW als Treibmittel in nicht lebensnotwendigen Anwendungen zu verbieten.[41] Infolgedessen wurden alle Haushaltsprodukte innerhalb von drei Jahren in den USA auf FCKW-freie Technologien umgestellt.[28] Die Produktion von FCKW wurde von der Europäischen Wirtschaftsgemeinschaft (EWG) auf dem Stand von 1980 eingefroren und die Verwendung von FCKW in Aerosolen bis Ende 1981 gegenüber 1976 um 30 % reduziert.[41]
Der Kongress der Vereinigten Staaten verabschiedete 1975 ein Gesetz, das die NASA mit der Überwachung der oberen Atmosphäre beauftragte, um die chemischen Prozesse in der oberen Erdatmosphäre besser zu verstehen. Diese begann 1978 mit der Beobachtung der globalen stratosphärischen Ozonwerte mit dem „Total Ozone Mapping Spectrometer“ (TOMS) an Bord des Nimbus-7-Satelliten.[45]
Wiener Übereinkommen

In der zweiten Hälfte der 1970er Jahre wurde deutlich, dass das Problem des Ozonabbaus nur durch internationale Zusammenarbeit gelöst werden kann. Auf einer UNEP-Tagung 1977 wurde ein „Weltaktionsplan für die Ozonschicht“ erarbeitet, der von 32 Staaten verabschiedet wurde.[46] Der Plan definierte den Forschungsbedarf in allen Bereichen des Ozonabbaus und seinen sozioökonomischen Auswirkungen. Neben den USA und UNEP beteiligten sich die Weltorganisation für Meteorologie (WMO), die Organisation für wirtschaftliche Zusammenarbeit und Entwicklung (OECD) und die Europäische Wirtschaftsgemeinschaft an den Forschungs- und Regulierungsbemühungen zur Prävention des Ozonabbaus. Weiterhin setzte die UNEP eine Arbeitsgruppe ein, um eine globale Konvention zum Schutz der Ozonschicht auszuarbeiten. Das Ergebnis war das „Wiener Übereinkommen zum Schutz der Ozonschicht“, das im März 1985 auf einer Konferenz von 43 Staaten verabschiedet wurde.[41] Darin heißt es unter anderem:
„Die Vertragsparteien treffen geeignete Maßnahmen […] um die menschliche Gesundheit und die Umwelt vor schädlichen Auswirkungen zu schützen, die durch menschliche Tätigkeiten, welche die Ozonschicht verändern oder wahrscheinlich verändern, verursacht werden oder wahrscheinlich verursacht werden.“
Das Wiener Übereinkommen fordert eine internationale Zusammenarbeit in den Bereichen Forschung, Überwachung und Informationsaustausch. Es ist als Rahmenabkommen konzipiert, das keine Reduktion der Emissionen von ozonabbauenden Substanzen vorschreibt. Die Bedeutung des Übereinkommens liegt darin, dass es die Grundlage für die Verhandlungen weiterer Abkommen, insbesondere des Montreal-Protokolls und seiner nachfolgenden Änderungen, geschaffen hat.[48]
Montreal-Protokoll

In der Zeit zwischen der Veröffentlichung von Molina und Rowland Mitte der 1970er Jahre und dem Beginn der Verhandlungen zum Montreal-Protokoll schwankten die wissenschaftlichen Vorhersagen über den Ozonabbau durch FCKW erheblich. Diese Unsicherheit führte dazu, dass sich einige Länder zunächst gegen eine Regulierung der FCKW aussprachen. Die öffentliche Debatte und die Verhandlungen erreichten jedoch einen Wendepunkt mit der Entdeckung des sogenannten „Ozonlochs“. Seine Entdeckung signalisierte eine bedenklich hohe Wahrscheinlichkeit einer globalen Umweltkatastrophe und zeigte, dass das Problem des Ozonabbaus größer war als erwartet. Es wurde deutlich, dass eine rasche globale Lösung unbedingt erforderlich war.[49] Auf einer Konferenz im September 1987 wurde schließlich das Montreal-Protokoll über Substanzen, die zum Abbau der Ozonschicht führen, von 24 Staaten und der Europäischen Wirtschaftsgemeinschaft verabschiedet und trat am 1. Januar 1989 in Kraft. Seitdem wurde es mehrfach überarbeitet.[50]
Als Folge des Montreal-Protokolls ging die jährliche weltweite Produktion von FCKW von rund 1,2 Millionen Tonnen im Jahr 1986 auf 80.000 Tonnen im Jahr 2006 zurück und wurde 2016 mit 23.000 Tonnen fast vollständig eingestellt. In ähnlicher Weise sank der weltweite Verbrauch von 1,3 Millionen Tonnen im Jahr 1986 auf 86.000 Tonnen im Jahr 2006 und 22.000 Tonnen im Jahr 2016. Das Montreal-Protokolls gilt daher als ein gutes Beispiel, wie Wissenschaft als Grundlage für politische Entscheidungen genutzt werden kann, um Verbesserungen für Gesundheit, Klima und Umwelt zu erzielen.[49]
Viele FCKW-Ersatzstoffe der ersten Generation sind in der Atmosphäre langlebig und haben ein hohes Treibhauspotenzial, insbesondere die teilhalogenierten Fluorchlorkohlenwasserstoffe (H-FCKW) und die teilhalogenierten Fluorkohlenwasserstoffe (HFKW). Aus diesem Grund wurde 2016 die Kigali-Änderung des Montreal-Protokolls von zahlreichen Ländern ratifiziert, die den Ausstieg aus der Produktion dieser Substanzen reguliert.[51] Zu den durch das Montreal-Protokoll regulierten Einzelsubstanzen und Substanzklassen gehörten im Jahr 2020 die FCKW, Halone, andere vollhalogenierte FCKW, Tetrachlorkohlenstoff, Methylchloroform, teilhalogenierte Fluorchlorkohlenwasserstoffe, teilhalogenierte Fluorbromkohlenwasserstoffe, Brommethan, Bromchlormethan sowie teilhalogenierte Fluorkohlenwasserstoffe.[52]

Da die Schädigung der Vegetation durch eine erhöhte UV-B-Strahlung ihre Fähigkeit beeinträchtigt, der Atmosphäre Kohlenstoffdioxid zu entziehen, ist der Ozonabbau auf diese Weise mit dem Kohlenstoffzyklus verbunden. Der durch das Montreal-Protokoll verhinderte Ozonabbau und der dadurch erreichte Schutz der Vegetation hat die Erde vor einer zusätzlichen Erwärmung um 0,85 °C bewahrt.[53] Ban Ki-moon, zum damaligen Zeitpunkt Generalsekretär der Vereinten Nationen, betonte dies 2010 anlässlich des „Internationalen Tages zum Schutz der Ozonschicht“.
“Because ozone-depleting chemicals are also greenhouse gases, the Montreal Protocol has already averted greenhouse gas emissions equivalent to more than 135 billion tonnes of carbon dioxide, and will continue to play an important role.”
„Da ozonabbauende Chemikalien auch Treibhausgase sind, hat das Montreal-Protokoll bereits Treibhausgasemissionen entsprechend einer Menge von mehr als 135 Milliarden Tonnen Kohlenstoffdioxid verhindert und wird auch in Zukunft eine wichtige Rolle spielen.“
Verschiedene Projektionen, die von einer mehr oder weniger raschen Erholung der Ozonschicht ausgehen, erwarten basierend auf den Ergebnissen des Montreal-Protokolls eine Rückkehr zu den Ozonwerten von vor 1980 zwischen Mitte und Ende des 21. Jahrhunderts.[55]
Quellgase

Substanzen mit Einfluss auf den Ozonabbau werden nach verschiedenen Kriterien klassifiziert. Neben ihrer chemischen Struktur werden die beteiligten Gase entsprechend ihrer Rolle beim Ozonabbau als Quellgase, Produktgase, Reservoirgase und reaktive Gase bezeichnet. Quellgase sind in der Troposphäre freigesetzte Substanzen, die in der Stratosphäre photolytisch ozonabbauende Spezies freisetzen. Nach ihrer Herkunft sind sie entweder rein anthropogenen Ursprungs, sowohl anthropogenen als auch natürlichen Ursprungs oder überwiegend natürlichen terrestrischen oder aquatischen Ursprungs.
Die Quellgase werden nach ihrer atmosphärischen Lebensdauer unterteilt. Es gibt langlebige Quellgase mit einer atmosphärischen Lebensdauer von mehr als einem halben Jahr, die als „ozonabbauende Substanzen“ bezeichnet werden, nach dem englischen „ozone depleting substances“ als ODS abgekürzt. Substanzen mit einer Lebensdauer von weniger als einem halben Jahr werden als „sehr kurzlebige Substanzen“ bezeichnet, nach der englischen Bezeichnung „very short-lived substances“ als VSLS abgekürzt.[57]
Beide Arten von Quellgasen tragen zum stratosphärischen Ozonabbau bei. Für die sehr kurzlebigen Substanzen gibt es sowohl natürliche als auch anthropogene Quellen; viele bromierte und iodierte kurzlebige Substanzen entstehen natürlich in den Ozeanen oder auf Böden, chlorierte kurzlebige Substanzen sind oft anthropogenen Ursprungs.[56] Sehr kurzlebige Substanzen, die während ihres Transports in die Stratosphäre chemischen Umwandlungen unterliegen, werden nicht als Quellgase, sondern als Produktgase bezeichnet.
Durch photochemische Reaktionen werden aus Quell- und Produktgasen reaktive Gase freigesetzt, die durch weitere Reaktionen in Reservoirgase umgewandelt werden. Die Reaktiv- und Reservoirgase enthalten alle Halogenatome, die ursprünglich in den Quell- und Produktgasen vorhanden waren. Die Gesamtmenge an Halogenen in der Stratosphäre dieser Reaktiv- und Speichergase wird als äquivalentes wirksames stratosphärisches Chlor, nach der englischen Bezeichnung „equivalent effective stratospheric chlorine“ als EESC abgekürzt.[58]
Fluorchlorkohlenwasserstoffe und Halone
- Fluorchlorkohlenwasserstoffe
 Dichlordifluormethan
Dichlordifluormethan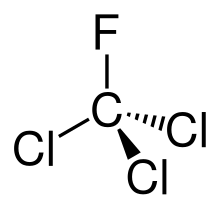 Trichlorfluormethan
Trichlorfluormethan
- Halone
 Bromchlordifluormethan
Bromchlordifluormethan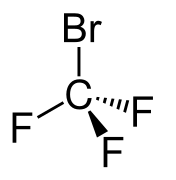 Bromtrifluormethan
Bromtrifluormethan
Zu den langlebigen Quellgasen gehören die halogenhaltigen Substanzen wie voll- und teilhalogenierte Fluorchlorkohlenwasserstoffe, die brom- und fluorhaltigen Halone, Tetrachlormethan, Chlor- und Brommethan. Viele dieser Substanzen sind in Europa durch die Verordnung (EG) Nr. 1005/2009 reguliert.[59] Fluorchlorkohlenwasserstoffe sind ungiftige, nicht brennbare Substanzen, die aus Kohlenstoff-, Chlor- und Fluoratomen aufgebaut sind. Technisch lassen sie sich durch Fluorierung von Chloralkanen mit wasserfreiem Fluorwasserstoff an Festbettkatalysatoren aus Aluminiumfluorid, durch die Swarts-Reaktion und weitere Methoden herstellen.[60]
Die weltweite Produktion von Fluorchlorkohlenwasserstoffen stieg von 544 Tonnen im Jahr 1934 auf 812.522 Tonnen im Jahr 1974.[61] Die weltweiten Emissionen von Trichlorfluormethan, Dichlordifluormethan und 1,1,2-Trichlor-1,2,2-trifluorethan sowie einiger kleinvolumiger FCKW lagen Anfang der 1980er Jahre bei etwa 800.000 Tonnen pro Jahr und erreichten Ende der 1980er Jahre mit 1.100.000 Tonnen pro Jahr ihren Höhepunkt.[62]
Die ozonabbauende Wirkung einer Substanz wird mit einer Maßzahl beschrieben, dem Ozonabbaupotential. Das Ozonabbaupotential einer Substanz ist ein Maß für seine Fähigkeit, stratosphärisches Ozon abzubauen. Es handelt sich um einen relativen Wert, der die Wirkung im Vergleich zu Trichlorfluormethan beschreibt, für das ein Ozonabbaupotential von 1,0 festgelegt wurde.[63] Viele ozonabbauende Substanzen besitzen zudem ein Treibhauspotential, das angibt, wie viel Wärmestrahlung ein Gas im Vergleich zu Kohlenstoffdioxid über einen bestimmten Zeitraum absorbieren würde.
| Ozonabbau-, Treibhauspotential und atmosphärische Lebensdauer einiger Halogenkohlenwasserstoffe[64][65][66][67] | |||
|---|---|---|---|
| FCKW/H-FCKW/Halone | Ozonabbaupotential | Treibhauspotential | Atm. Lebensdauer in Jahren |
| Trichlorfluormethan (CCl3F) | 1 | 4750 | 50 |
| Dichlordifluormethan (CCl2F2) | 1 | 10.900 | 100 |
| Chlorpentafluorethan (CClF2CF3) | 0,6 | 7370 | 1020 |
| Chlordifluormethan (CClF2H) | 0,055 | 1810 | 12 |
| Tetrachlormethan (CCl4) | 1,1 | 1730 | 26 |
| Tetrafluormethan (CF4) | 0 | 6630 | 50.000 |
| Bromtrifluormethan (CBrF3) | 12 | 5400 | 65 |

Obwohl die Herstellung und Verwendung von Trichlorfluormethan Anfang der 1990er Jahre in Deutschland verboten wurde, entweicht es aus alten Schaumstoffbeständen und Kühl- und Klimaanlagen. Nach einer Schätzung des Umweltbundesamtes aus dem Jahr 2009 enthält ein auf FCKW-Technologie basierender mittelgroßer Kühlschrank etwa 125 Gramm Dichlordifluormethan im Kühlmittelkreislauf und 320 Gramm Trichlorfluormethan in der Wärmedämmung.[68] Trotz des Verbots von Trichlorfluormethan, das seit 2010 in China gilt, wurde Schätzungen zufolge weiterhin rund 70 % der dort produzierten Polyurethane mit Trichlorfluormethan geschäumt. Anfang 2021 gingen die Emissionen aus China stark zurück, drei Jahre nachdem die illegalen Emissionen erstmals publiziert wurden.[69]
Die Konzentration chlorhaltiger Quellgase in der Troposphäre aus langlebigen Substanzen ist rückläufig und lag im Jahr 2020 bei 3,22 ppb, 12 % unter dem Höchstwert von 1993. Den größten Anteil daran hatten mit 60 % die FCKW, insbesondere Trichlorfluormethan, Dichlordifluormethan und 1,1,2-Trichlor-1,2,2-trifluorethan. Der Anteil von Tetrachlormethan und der Gruppe der teilhalogenierten Kohlenwasserstoffe betrug je 10 % und Chlormethan 17 %. Der Anteil der sehr kurzlebigen Substanzen lag bei etwa 3,5 %.[70]
Neben den Halonen gehört Brommethan zu den bromierten langlebigen Substanzen anthropogenen und natürlichen Ursprungs. Mit einem Ozonabbaupotential von 0,6 und einer atmosphärischen Lebensdauer von 1,7 Jahren ist es als signifikant ozonabbauende Verbindung eingestuft.[71] Es ist ein Begasungsmittel, das als Insektizid zur Behandlung von Holz während des Transports oder auf landwirtschaftlichen Flächen zur Abtötung von Bodenschädlingen eingesetzt wird. Brommethan wurde 1982 in Deutschland und 2005 in den USA verboten. Im Rahmen des Montreal-Protokolls waren Entwicklungsländer verpflichtet, den Einsatz von Brommethan bis 2015 zu verbieten. Eine Ausnahme bildet Neuseeland, das die Verwendung von Brommethan erst 2033 einstellen will.[72]
Distickstoffmonoxid

Ebenfalls zu den langlebigen Quellgasen gehört Distickstoffmonoxid, auch bekannt unter dem Trivialnamen Lachgas. Es entsteht zum Teil durch natürlichen Prozesse, die Zunahme der atmosphärischen Konzentration ist jedoch hauptsächlich auf seine Entstehung als Nebenprodukt der Düngung und der Verbrennung von fossilen Brennstoffen, Biomasse und Biokraftstoffen zurückzuführen.[73] Die weltweiten anthropogenen Distickstoffmonoxid-Emissionen haben zwischen 1980 und 2020 um etwa 30 % zugenommen, was hauptsächlich auf die Stickstoffdüngung landwirtschaftlicher Nutzflächen zurückzuführen ist. Distickstoffmonoxid entsteht bei der bakteriellen Denitrifikation von Nitraten. Es ist ein Quellgas, das in der Troposphäre nicht abgebaut und in die Stratosphäre transportiert wird, wo es durch die Reaktion mit atomarem Sauerstoff zu einer Quelle von NOx-Radikalen wird, die in katalytischen Kreisläufen Ozon zerstören.[74] Distickstoffmonoxid ist sowohl eine ozonabbauende Substanz als auch ein starkes Treibhausgas, das massebezogen etwa 298-mal stärker wirkt als Kohlenstoffdioxid, mit einer atmosphärischen Lebenszeit von etwa 116 Jahren. Im Jahr 2018 lag seine Konzentration in der Atmosphäre bei 331 ppb und damit etwa 22 % über dem Wert des vorindustriellen Zeitalters.[74]
Wasser, Methan, Wasserstoff
Weitere Quellgase sind Wasserdampf (H2O), Methan (CH4) und molekularer Wasserstoff (H2) aus der Troposphäre. Wasserdampf gelangt zum Teil durch den Luftmassenaustausch mit der Troposphäre in die Stratosphäre, wobei jedoch ein Großteil des Wassers an der Tropopause ausgefroren wird. Eine weitere bedeutende Quelle ist die Oxidation von Methan. Wasser wiederum ist eine Quelle für Hydroxyl-Radikale, die zum Ozonabbau beitragen, und beeinflusst den Strahlungshaushalt der Erde.[3] Methan reagiert zudem mit atomarem Chlor zu Chlorwasserstoff. Wasserstoff spielt eine ähnliche Rolle wie Methan, da seine chemischen Reaktionen die Erzeugung von stratosphärischem Wasserdampf und Aerosolen beeinflussen.[75]
Sehr kurzlebige Substanzen

Zu den sehr kurzlebigen anthropogenen Substanzen gehören Chloroform (CHCl3) und Dichlormethan (CH2Cl2). Bromoform (CHBr3) und Dibrommethan (CH2Br2) sind sehr kurzlebige bromhaltige Quellgase natürlichen Ursprungs.[76] Der größte Eintrag von Bromoform in die Atmosphäre erfolgt durch die oberen Schichten der Ozeane, wo Braunalgen und Plankton als Hauptquellen vermutet werden. Die globalen natürlichen ozeanischen Bromoform-Emissionen liegen in der Größenordnung von 2,3 bis 3,3 Millionen Tonnen pro Jahr und sind damit wesentlich größer als anthropogene Quellen. Dibrommethan hat ein Ozonabbaupotenzial von 0,17 und eine atmosphärische Lebensdauer von etwa fünf Monaten. Die industrielle Verwendung ist im Vergleich zu Brommethan gering, die Verbindung wird meist als Zwischenprodukt bei Synthesen eingesetzt.[77] Zu den sehr kurzlebigen iodhaltigen Quellgasen gehören neben Iodmethan auch Iodethan, Diiodmethan, und Chloriodmethan.[76] Diese gelangen aus natürlichen ozeanischen Quellen in die Stratosphäre.[78]
Bei Produktgasen handelt es sich um Folgeprodukte sehr kurzlebiger Substanzen, die durch Photolyse oder chemische Reaktionen in anorganische Halogenverbindungen umgewandelt wurden und in dieser Form in die Stratosphäre gelangen.[79] Neben anorganischen Halogenen wie Chlorwasserstoff gehören auch Verbindungen wie Phosgen und partikelgebundenes Iod zu den Produktgasen. Inwieweit eine sehr kurzlebige Substanz als Quell- oder Produktgas in die Stratosphäre gelangt, hängt von verschiedenen Faktoren wie Auswaschungsprozessen in der Troposphäre und der Transportgeschwindigkeit der Substanzen in die Stratosphäre ab. Bei den chlorhaltigen sehr kurzlebigen Substanzen liegt der Anteil der Produktgase bei etwa 19 %, bei bromhaltigen bei etwa 57 % und bei iodhaltigen bei etwa 75 %.[80]
Reservoir- und reaktive Gase

Die photolytische Spaltung von Quellgasen wie FCKW und Halonen in der oberen Stratosphäre ist für die primäre Bildung von atomaren Halogenspezies verantwortlich. Ein großer Teil der aus den Quellgasen freigesetzten atomaren Halogene reagiert jedoch schnell zu Reservoirgasen wie Chlornitrat (ClONO2) oder Chlorwasserstoff (HCl), die selbst nicht am Ozonabbau beteiligt sind. In der unteren Stratosphäre ist die Konzentration der Quellgase noch hoch, bei einer Höhe von 30 Kilometern überwiegen die Anteile der Reservoirgase. Sie entstehen bei der Reaktion zwischen reaktiven Gasen wie Chlormonoxid und Stickstoffdioxid oder atomarem Chlor und Methan. Freigesetztes Brom wird ebenfalls in Reservoirgase wie Bromwasserstoff oder Bromnitrat umgewandelt. Die Stabilität der Bromreservoirgase ist jedoch geringer und Brom ist auf atomarer Basis etwa 50-mal stärker ozonabbauend als Chlor.[81]
Die aus der Photolyse von Quellgasen freigesetzten Halogene liefern zwar einen direkten Beitrag zum Ozonabbau, im Vergleich zu den aus Reservoirgasen wie Chlorwasserstoff und Chlornitrat und den entsprechenden Bromspezies freigesetzten reaktiven Gasen ist er jedoch gering, da deren Konzentration in der eigentlichen Ozonschicht wesentlich größer ist.[11]
Im polaren Winter werden die Reservoirgase durch heterogene Reaktionen an den Aerosolen der polaren Stratosphärenwolken in reaktive Gase wie molekulare Halogene, Halogenoxide oder hypohalogenige Säuren umgewandelt. Diese Gase werden im polaren Frühling durch die wiederkehrende Sonnenstrahlung photolysiert, so dass die Konzentration der katalytisch aktiven Spezies stark ansteigt. Der Grund für das Ozonloch über der Antarktis ist demzufolge nicht, dass dort mehr FCKW vorhanden sind, sondern dass die niedrigen Temperaturen die Bildung von polaren Stratosphärenwolken begünstigen, in denen die Umwandlung von Reservoirgasen in reaktive Gase stattfindet.[82]
Chemie des Ozonabbaus

Der Prozess des Ozonabbaus, beispielsweise durch FCKW, beginnt mit der Freisetzung dieser Quellgase an der Erdoberfläche. Da die Abbauraten der langlebigen FCKW geringer sind als ihre Emissionsraten und sie praktisch unlöslich in Wasser sind und daher nicht ausgewaschen werden, reichern sie sich in der Troposphäre an. Obwohl die FCKW-Moleküle eine höhere molare Masse als die Hauptbestandteile der Luft haben, werden sie in der Troposphäre durch Windkräfte vollständig vermischt. Durch die globale atmosphärische Zirkulation, bei der tropische Luft aus der Troposphäre in die Stratosphäre aufsteigt und beim Absinken polwärts wandert, gelangen die FCKW in die Stratosphäre.[83] In der oberen Stratosphäre werden sie durch UV-Strahlung photolysiert, wobei atomares Chlor freigesetzt wird. Ein Teil der freigesetzten Chloratome trägt direkt zum Ozonabbau in der oberen Stratosphäre bei, ein großer Teil wird in relativ UV-stabile Speichergase wie Chlornitrat und Chlorwasserstoff umgewandelt und in tiefere Schichten der Stratosphäre transportiert.[83]
Die Reaktionen, die zum Ozonabbau beitragen, lassen sich in Gasphasenreaktionen und heterogene Reaktionen unterteilen. Bei den Gasphasenreaktionen sind im Bezug auf den Ozonabbau verschiedene Reaktionsklassen zu unterscheiden. Zum einen gibt es Reaktionen von Sauerstoff und Ozon, die natürlicherweise unter dem Einfluss der solaren UV-Strahlung ablaufen.[84] Zum anderen gibt es Reaktionen, die durch natürliche oder anthropogene Spurengase hervorgerufen werden und die zum Ozonabbau führen. Die Umwandlung dieser Spurengase untereinander zu reaktiven oder Speichergasen stellt eine weitere Klasse von stratosphärischen Gasphasenreaktionen dar. Die an diesen homogenen Reaktionen beteiligten Spezies basieren überwiegend auf Wasserstoff-, Stickstoff- und Halogenoxiden oder atomaren Halogenen. An den Gasphasenreaktionen ist üblicherweise mindestens ein Radikal beteiligt.[85]
Der Begriff „heterogene Reaktionen“ umfasst in der Atmosphärenchemie alle Reaktionen, die nicht in der Gasphase ablaufen. Dazu gehören sowohl Reaktionen an den Oberflächen fester oder flüssiger Partikel als auch Reaktionen, die in flüssigen Aerosoltröpfchen in der Atmosphäre ablaufen, auch wenn es sich hierbei im Grunde um homogene Flüssigphasenreaktionen handelt.[86] Neben den Gasphasenreaktionen, die letztlich zum Ozonabbau führen, tragen heterogene Reaktionen zur Konvertierung von Reservoirgasen in reaktive Gase sowie zur Entfernung von Stickstoffverbindungen aus der Stratosphäre bei, die somit nicht mehr zur Deaktivierung von reaktivem Chlor- und Bromverbindungen dienen können. An den heterogenen Reaktionen sind überwiegend nicht-radikalische Moleküle beteiligt.[85]
Ozon-Sauerstoff-Zyklus

Ozon wird in der Stratosphäre durch photochemische Prozesse ständig sowohl gebildet als auch abgebaut. Die Synthese von Ozon in der Stratosphäre erfolgt in zwei Schritten, die Teil des Ozon-Sauerstoff-Zykluses sind. Dieser wird auch als Chapman-Zyklus bezeichnet, benannt nach dem britischen Geophysiker Sydney Chapman. Zunächst erfolgt die photolytische Spaltung von Sauerstoffmolekülen in atomaren Sauerstoff durch Absorption von UV-C-Strahlung mit einer Wellenlänge kleiner als 242 Nanometern. Im zweiten Schritt erfolgt die Synthese von Ozon (O3) durch Reaktion des atomaren Sauerstoffs mit molekularem Sauerstoff (O2) und einem inerten Stoßpartner oder Mediator (M), zum Beispiel Stickstoff oder einem weiteren Sauerstoffmolekül.[87]
Die globale stratosphärische Ozonproduktion ist mit durchschnittlich 125 Milliarden Tonnen pro Jahr außerordentlich hoch. Sie ist in der unteren tropischen Stratosphäre am höchsten, da die kurzwellige Sonnenstrahlung in Tropen besonders intensiv ist. In der Stratosphäre unterhalb von etwa 18 bis 20 Kilometern Höhe sowie in der Troposphäre findet keine photolytisch initiierte Ozonbildung statt, da die für die Ozonbildung notwendige UV-C-Strahlung zuvor absorbiert wird und nicht in die unteren Luftschichten vordringt.[87]
Die Produktion des stratosphärischen Ozons steht in einem dynamischen Gleichgewicht mit seinem photochemischen Abbau. Die dazu benötigte Strahlung ist weniger energiereich als die zur Spaltung eines Sauerstoffmoleküls. Beim Abbau von Ozon durch dessen photolytische Spaltung reagieren insgesamt zwei Ozonmoleküle zu drei Sauerstoffmolekülen. Als Zwischenprodukt tritt je nach der absorbierten Wellenlänge atomarer Sauerstoff im elektronischen Grundzustand O(3P) oder im ersten angeregten Zustand O(1D) auf.
Der durch die Ozonphotolyse erzeugte atomare Sauerstoff reagiert überwiegend mit molekularem Sauerstoff schnell wieder zu Ozon, nur ein kleiner Teil reagiert mit Ozon zu molekularem Sauerstoff.[88] Die Ozonkonzentration in der Stratosphäre würde konstant bleiben, wenn das photostationäre Gleichgewicht nicht gestört würde. Die rein photochemischen Auf- und Abbaureaktionen würden jedoch zu einer höheren Ozonkonzentration führen als die beobachtbare.[89]
Konvertierung der Quellgase

Der Abbau der Fluorchlorkohlenwasserstoffe erfolgt photochemisch in der oberen Stratosphäre. Durch die photolytische Dissoziation der Kohlenstoff-Chlor-Bindungen werden Chlor- und Perhalogenalkylradikale freigesetzt. Für das Quellgas Trichlorfluormethan zum Beispiel sind folgende Abbaureaktionen möglich:[90]
Eine weitere Möglichkeit, Quellgase in reaktive Gase umzuwandeln, ist die Reaktion mit aktiviertem atomarem Sauerstoff.[90]
Distickstoffmonoxid und Wasser regieren mit atomarem Sauerstoff zu Stickstoffmonoxid und Hydroxyl-Radikalen und Wasser wird in der oberen Stratosphäre durch UV-C-Strahlung mit einer Wellenlänge kleiner 200 Nanometern zum Hydroxyl-Radikal und atomarem Wasserstoff photolysiert.[91][92]
Katalytischer Ozonabbau

Die Ozonkonzentration wird durch Spurengase, die homogenkatalytisch Ozon abbauen, auf das beobachtete Maß reduziert. Vereinfacht kann der katalytische Ozonabbau dargestellt werden als:
Gesamtreaktion:
Dabei oxidiert Ozon das als Katalysator wirkende Spurengas „X“ zunächst zu „XO“. In einer Folgereaktion mit einem Sauerstoffatom wird der Katalysator unter Freisetzung von molekularem Sauerstoff wieder gebildet und steht für einen neuen Zyklus zur Verfügung. Im Vergleich zur Reaktion von atomarem Sauerstoff mit Ozon laufen die katalytischen Reaktionen sehr viel schneller ab. Der Katalysator kann einen solchen Katalysezyklus mehrere Tausende Mal durchlaufen und dabei die entsprechende Menge Ozon abbauen.[11] Als Katalysatoren wurden unter anderem das aus Wasserdampf gebildete Hydroxyl-/Hydroperoxylradikalpaar (HO/HO2) und das aus Distickstoffmonoxid gebildete Radikalpaar Stickstoffmonoxid/Stickstoffdioxid (NO/NO2) identifiziert.[37] Der größte Teil des seit den späten 1970er Jahren beobachteten Ozonabbaus wurde jedoch durch chemische Prozesse auf Chlorbasis verursacht.[88] Die aus FCKW freigesetzten Fluoratome sind ebenfalls reaktiv und bauen über einen Fluor/Fluoroxid-Kreislauf Ozon ab. Da atomares Fluor schnell mit Methan zu Fluorwasserstoff reagiert, der stabil ist und Ozon nicht weiter abbaut, ist die Wirkung jedoch gering.[93] Fluorkohlenwasserstoffe haben daher praktisch kein Ozonabbaupotenzial. Die Bindung von Brom in Bromwasserstoff oder Bromnitrat ist dagegen weniger stabil als die von Chlor in den entsprechenden Verbindungen, so dass es schnell freigesetzt wird und Ozon effektiver abbaut als Chlor.[88]
Chlormonoxid reagiert sowohl mit atomarem Sauerstoff zu atomarem Chlor und molekularem Sauerstoff
als auch über die Bildung des dimeren Produkts und dessen anschließender photolytischer Spaltung:
Das Chlormonoxiddimer wird leicht photolysiert und setzt dabei atomares Chlor frei, das weiteres Ozon abbaut.[94] Die Reaktion von Chlormonoxid mit Brommonoxid verläuft unter Bildung der Interhalogenverbindung Bromchlorid. Als Nettoreaktion findet die Bildung von drei Sauerstoffmolekülen aus zwei Ozonmolekülen statt.[95]
Aktivierung und Deaktivierung in der Gasphase

Die Verbindungen, die Ozon katalytisch abbauen, werden über eine Reihe von Reaktionen schließlich in nicht-katalytisch aktive Reservoirgase umgewandelt und damit deaktiviert. So reagieren beispielsweise Stickstoffmonoxid und Stickstoffdioxid mit Ozon zum Nitrat-Radikal, das bei Dunkelheit, wenn der photolytische Abbau zum Erliegen kommt, mit Stickstoffdioxid zu Distickstoffpentoxid reagiert.
Die Deaktivierung von atomarem Chlor erfolgt durch Reaktion mit Methan zu Chlorwasserstoff und Chlormonoxid reagiert mit Stickstoffdioxid zu Chlornitrat.
Weitere Reservoirgase sind Peroxosalpetersäure sowie Bromnitrat.[96][91]
Ein Teil der Reservoirgase wird durch photolytische Spaltung wieder in katalytisch aktive Spezies überführt. So wird Chlornitrat zu atomarem Chlor und dem Nitrat-Radikal beziehungsweise zu Chlormonoxid und Stickstoffdioxid photolysiert.[90]
Die Reservoirgase sind in der unteren Stratosphäre aufgrund der dort schwächeren UV-Strahlung relativ stabil und werden teilweise in die Troposphäre transportiert. Dort werden sie als sogenannte Senkengase durch Regen oder Schnee gebunden und ausgewaschen.[97]
Auswaschung
Das ozonabbauende Chlor reagiert schließlich zu Salzsäure, die wieder in die Troposphäre transportiert wird, sich dort in Wasser löst und abregnet. Bei der Photolyse fluorhaltiger Gase entstehen Perfluoralkylradikale wie das Trifluormethylradikal, die zu Carbonylfluorid oxidiert werden. Carbonylfluorid wiederum reagiert mit Wasser zu Kohlenstoffdioxid und Fluorwasserstoff, der keine Radikalpaare bildet und nicht am Ozonabbau beteiligt ist. Dieser wird ebenfalls in der Troposphäre ausgewaschen. Auf diese Weise werden die Fluorchlorkohlenwasserstoffe langsam aus dem atmosphärischen System entfernt. Durch die Brewer-Dobson-Zirkulation, ein globales atmosphärisches Zirkulationsmuster, bei dem Luft aus der tropischen Troposphäre in die Stratosphäre aufsteigt und sich beim Absinken polwärts bewegt, gelangen innerhalb von fünf Jahren etwa 10 % der Troposphäre in die obere Stratosphäre.[88][98]
Um einen bestimmten FCKW in der Stratosphäre vollständig photochemisch abzubauen, muss dieser Prozess mehr als zehnmal durchlaufen werden. Die Entfernung eines vollständig abbaubaren FCKW aus der Atmosphäre dauert daher mindestens 50 Jahre, wobei Verdünnungseffekte den Prozess verlängern. Wird ein FCKW nicht vollständig abgebaut, ist seine atmosphärische Lebensdauer entsprechend länger.[88]
Konvertierung von Reservoirgasen

Heterogene Reaktionen sind beispielsweise die Reaktion der Reservoirgase Chlornitrat und Chlorwasserstoff zu Salpetersäure und molekularem Chlor, die Reaktion von Chlornitrat mit Wasser zu Salpetersäure und hypochloriger Säure und die Reaktion von hypochloriger Säure und Chlorwasserstoff zu Wasser und molekularem Chlor. Im Polarwinter finden nur in begrenztem Umfang photolytische Reaktionen statt. Daher werden in der winterlichen antarktischen Stratosphäre die Reservoirgase vollständig in reaktive Gase umgewandelt, da die Geschwindigkeit der heterogenen Reaktionen im Vergleich zu den Gasphasenreaktionen, die die Reservoirgase wieder erzeugen, hoch ist.[99] Erst durch die beginnende Sonneneinstrahlung im polaren Frühling werden Moleküle wie Chlor oder hypochlorige Säure zu atomarem Chlor photolysiert, das katalytisch Ozon abbaut.
Entscheidend für die Konvertierung der halogenhaltigen Reservoirgase ist das Vorhandensein von polaren Stratosphärenwolken. Diese bieten die für den heterogenen Reaktionsverlauf notwendigen Oberflächen. Die atmosphärischen Bedingungen während der antarktischen Polarnacht begünstigen die Entstehung der polaren Stratosphärenwolken. Auf der Südhalbkugel bildet sich im Winter um die Antarktis ein Polarwirbel, der verhindert, dass warme Luft landeinwärts strömt. Dadurch sinkt die Temperatur auf unter -78 °C, ab der sich polare Stratosphärenwolken bilden können. Da diese niedrige Temperatur in der Arktis seltener erreicht wird, sind polare Stratosphärenwolken auf der Südhalbkugel wesentlich häufiger zu beobachten als auf der Nordhalbkugel.[100]
Es gibt verschiedene Arten von polaren Stratosphärenwolken, die unterschiedliche Auswirkungen auf den Ozonabbau haben. Polare Stratosphärenwolken vom Typ Ib sind flüssige Aerosoltröpfchen, eine unterkühlte ternäre Lösung aus Schwefelsäure, Salpetersäure und Wasser, die Chlorspezies aktivieren und Stickstoffspezies deaktivieren. Im Gegensatz dazu führen feste Partikel des Typs Ia zur Denitrifizierung und Trocknung der mittleren Stratosphäre, die durch das Absinken größerer Partikel in die untere Stratosphäre und Troposphäre verursacht werden.[100]
Denitrifizierung

Durch Hydrolyse von Distickstoffpentoxid mit Wasser an der Oberfläche von Sulfataerosolpartikeln entsteht Salpetersäure, die ebenfalls durch Reaktion von Stickstoffdioxid mit Hydroxyl-Radikalen gebildet wird.
Die Kondensation der Salpetersäure auf den Partikeln der polaren Stratosphärenwolken entzieht sie der Photolyse durch die Sonnenstrahlung. Durch das nachfolgende Absinken der salpetersäurehaltigen Partikel wird die gebundene Salpetersäure aus der Stratosphäre entfernt, was als Denitrifizierung bezeichnet wird. Dies verhindert die Freisetzung und Photolyse von Salpetersäure zu Wasser und Stickstoffdioxid, das durch Reaktion mit Chlormonoxid zu dessen Deaktivierung beitragen könnte. Gleichzeitig wird durch die Sedimentation das in der Salpetersäure chemisch gebundene Wasser entfernt, so dass der Prozess auch zur Trocknung der Stratosphäre beiträgt.[11]
Einfluss von Vulkanausbrüchen und großen Waldbränden

Große Vulkanausbrüche verursachen oft eine mehrjährige Störung der Strahlungsbilanz der Erde, vor allem durch die Emission von Schwefeldioxid. Andere schwefelhaltige Vulkangase wie Schwefelwasserstoff und Carbonylsulfid werden schnell zu Schwefeldioxid oxidiert. Dieses reagiert mit dem Hydroxyl-Radikal zum Bisulfit-Radikal und anschließender Oxidation zu Schwefeltrioxid und unter Wasseraufnahme zu Schwefelsäure.[101]
Während die vulkanischen Sulfataerosole in der Stratosphäre die Erdoberfläche durch Reflexion der Sonnenstrahlung abkühlen, erwärmen sie die Stratosphäre durch Absorption der terrestrischen Strahlung. Außerdem kann der Abkühlungstrend die Menge an Wasserdampf in der Atmosphäre verringern, was den Treibhauseffekt abschwächt und die Abkühlung verstärkt. Diese Rückkopplung gilt ebenso für die Erwärmung.[102]
Aerosole, Aschepartikel und Wasserdampf, die durch Vulkanausbrüche und große Waldbrände in die Stratosphäre eingetragen werden, können neben dem Strahlungshaushalt auch chemische Reaktionen und atmosphärische Transportprozesse verändern, die den Ozongehalt in der Stratosphäre beeinflussen. Rauchpartikel können eine heterogene Chloraktivierung bewirken, die zu einer Abnahme von Chlorwasserstoff und einer Zunahme von Chlormonoxid in der Stratosphäre führt. Darüber hinaus können neben Schwefeldioxid große Mengen an Chlor- und Bromverbindungen in die Stratosphäre gelangen. Beim Ausbruch des Samalas 1257, einer der stärksten Ausbrüche des gesamten Holozäns, wurden etwa 158 Millionen Tonnen Schwefeldioxid, 227 Millionen Tonnen Chlor und etwa 1,3 Millionen Tonnen Brom ausgestoßen.[103]
Ausbruch des Pinatubo 1991

Der Ausbruch des Pinatubo im Juni 1991 war der größte des 20. Jahrhunderts, dessen Auswirkungen von verschiedenen Instrumenten der NASA und der National Oceanic and Atmospheric Administration (NOAA), die nationale Ozean- und Atmosphärenbehörde der USA, eingehend beobachtet wurden. Darunter waren das Stratospheric Aerosol and Gas Experiment II an Bord des Earth Radiation Budget Satellite der NASA sowie Ballon-, Flugzeug- und bodengestützte Instrumente, um die Schwefeldioxidemissionen, die Verteilung von Aerosolen und die Konzentration von Ozon und anderen Spurengase zu überwachen. Die mit diesen Instrumenten gesammelten Daten waren entscheidend für das Verständnis der Auswirkungen des Pinatubo-Ausbruchs auf die Ozonschicht.[104]
Durch den Ausbruch wurden etwa 20 Millionen Tonnen Schwefeldioxid in die Atmosphäre geschleudert, was einer Menge von 30 Millionen Tonnen Sulfataerosol entspricht.[86] Da es in der Stratosphäre keine Regenwolken gibt, die Aerosole auswaschen könnten, verblieben diese jahrelang in der Stratosphäre. Erst die atmosphärische Zirkulation transportierte die Aerosole in die Troposphäre, wo sie ausgewaschen werden konnten. Die Folge der Aerosolinjektion war eine mehrjährige Abkühlung der Erdoberfläche.[105]
Mit zunehmender Aerosolkonzentration und -oberfläche wurde der Effekt der Chloraktivierung durch heterogene Reaktionen verstärkt. Zusätzlich wurde eine Erhöhung der Salpetersäurekonzentration durch verstärkte Hydrolyse von Distickstoffpentoxid an der Oberfläche von Sulfataerosolpartikeln beobachtet. Beide Effekte trugen auch in den mittleren Breiten zum Ozonabbau bei, da die Hydrolyse von Distickstoffpentoxid die Konzentration von NOx-Spezies reduzierte. Dadurch wurde indirekt der katalytische Ozonabbau durch Chlormonoxid verstärkt, da dieses nicht mehr in das katalytisch inaktive Chlornitrat umgesetzt werden konnte.[106]
Ausbruch des Hunga Tonga 2022

Der Vulkanausbruch des Hunga Tonga 2022 schleuderte die gewaltige Menge von etwa 150 Millionen Tonnen Wasser bis zu 55 Kilometer hoch in die Atmosphäre, die bislang höchste gemessene Höhe einer Vulkanfahne. Dies verursachte eine Erwärmung der Stratosphäre und einen Ozonverlust von 0,5 ppmv in der Vulkanfahne, was auf eine effektive heterogene Chloraktivierung hindeutet, die wahrscheinlich durch feuchte vulkanische Aerosole verursacht wurde.[107] Nachdem 2019 das kleinste antarktische Ozonloch seit 1982 gemessen wurde, erreichte es im September 2023 eine Größe von 26 Millionen Quadratkilometern und war damit das zwölftgrößte seit 1979, wahrscheinlich verursacht durch die Wasserdampffahne der Hunga-Tonga-Eruption.[108] Das zusätzliche Wasser erhöhte die Konzentration von Hydroxyl-Radikalen, was in der oberen Stratosphäre zu Ozonabbau führte. In der unteren Stratosphäre verstärkte der Wasserüberschuss vermutlich die Bildung polarer Stratosphärenwolken und damit den halogenbedingten Ozonabbau.[109]
Magmatische Großprovinzen
Magmatische Großprovinzen fielen mit mindestens drei, möglicherweise allen fünf großen Massenaussterben der Erdgeschichte zusammen. Die zum Teil Jahrmillionen andauernden Eruptionen wie in Sibirien oder Indien hatten vielfältige Auswirkungen auf die Umwelt. Funde von mutierten Sporen und Pollen im Zusammenhang mit der Perm-Trias-Grenze und der Trias-Jura-Grenze könnten auf einen durch vulkanische Aktivität verursachten Ozonabbau und die Schädigung der Flora durch erhöhte UV-B-Strahlung hindeuten.[110] Andere Effekte wie die globale Erwärmung, saurer Regen und der Eintrag toxischer Metalle in die Meere trugen neben einem möglichen Ozonabbau zu den Umweltstörungen bei. Der Beitrag der einzelnen Stressfaktoren, die zum Aussterben führten, ist nur schwer zu bestimmen.[111]
Waldbrände

Bei großen Waldbränden wie den Buschfeuern 2019/2020 in Australien bilden sich Pyrocumulonimbus-Wolken, die Rauch und Spurengase in die Stratosphäre transportieren. Rußpartikel sind meist größer als Sulfatpartikel und bieten eine größere Oberfläche für heterogene chemische Prozesse. Zudem heizt Ruß die Stratosphäre effizienter auf, da er sowohl die ausgehende Infrarotstrahlung als auch die eingehende Sonnenstrahlung absorbiert. Die Heizeffekte und die Spurengase führten zu einem Ozonabbau von 50 Dobson-Einheiten in den betroffenen Luftmassen.[113] Die australischen Waldbrände im Jahr 2020 führten zu den ersten größeren Auswirkungen auf die globale Temperatur in der unteren Stratosphäre seit dem Ausbruch des Pinatubo im Jahr 1991. Darüber hinaus wurde einige Monate nach den Bränden Ozon in der Stratosphäre der mittleren Breiten abgebaut.[114]
Als Folge der Waldbrände in den borealen Wäldern der Nordhalbkugel 2019 wurde im Jahr 2020 über der Arktis ein starker Ozonabbau in der Stratosphäre beobachtet. Dies wurde auf den Einfluss organischer Aerosole zurückgeführt, die durch die Brände entstanden waren. Mit Hilfe von Aerosol-Lidarmessungen konnten eine erhöhte Partikelzahl und Oberflächenkonzentration gemessen werden. Die Rauchpartikelkonzentrationen waren im Jahr 2020 etwa um den Faktor 10 und im Jahr 2021 etwa um den Faktor 5 höher als der stratosphärische Aerosolhintergrund.[112]
Junge-Schicht
Die Junge-Schicht, benannt nach Christian Junge, einem ehemaligen Direktor des Max-Planck-Institut für Chemie in Mainz, ist eine globale Aerosolschicht in einer Höhe von etwa 15 bis 30 Kilometern und einer Dicke von 3 bis 9 Kilometern, die Aerosole aus verdünnter Schwefelsäure enthält. Die Schwefelsäureaerosole entstehen durch Oxidation schwefelhaltiger Substanzen wie Schwefeldioxid, Schwefelwasserstoff, Dimethylsulfid, Kohlenstoffdisulfid und Carbonylsulfid aus vulkanischen und biologischen Quellen.[100]
Heterogene Reaktionen, bei denen reaktive Gase aus Reservoirgasen freigesetzt werden, finden nicht nur in polaren Stratosphärenwolken, sondern auch in mittleren Breiten statt. Dort bieten die Sulfattröpfchen der Junge-Schicht eine Oberfläche für diese Prozesse, wie beispielsweise die Freisetzung von molekularem Chlor.[115]
Auswirkungen des Ozonabbaus
| UV-Bereich | Wellenlänge in [nm][116] |
|---|---|
| UV-A | 380–315 |
| UV-B | 315–280 |
| UV-C | 280–100 |
Die Auswirkungen des Ozonabbaus auf die menschliche Gesundheit lassen sich in direkte und indirekte Effekte unterteilen. Eine direkte Auswirkung ist die erhöhte UV-Strahlung, die auf die Haut oder die Augen trifft und zu akuten Schäden wie Sonnenbrand oder chronischen Schäden wie Hautkrebs oder grauem Star führen kann. Eine mögliche indirekte Folge des Ozonabbaus ist eine erhöhte UV-Strahlung in der Troposphäre und damit eine verstärkte Bildung von bodennahem Ozon, was zu einer Zunahme von Atemwegserkrankungen führen kann.[117]
UV-Strahlung wird in UV-A-, UV-B- und UV-C-Strahlung eingeteilt, wobei diese Einteilung willkürlich ist. Die für Lebewesen extrem schädliche UV-C-Strahlung wird komplett von Sauerstoff und Ozon in der oberen Atmosphäre absorbiert und erreicht nicht den Erdboden. UV-B-Strahlung wird zu etwa 95 % von der Ozonschicht absorbiert. Die Ultraviolettstrahlung macht etwa 8 bis 9 % der gesamten Sonnenstrahlung aus, wobei der UV-A-Anteil etwa 6,3 % und der UV-B-Anteil etwa 1,5 % beträgt.[118] Nach Schätzungen der US-amerikanischen Umweltschutzbehörde EPA hat eine Abnahme des stratosphärischen Ozons um 1 % eine Zunahme der UV-B-Strahlung am Erdboden um 2 % zur Folge.[41] Die positiven Wirkungen der UV-Strahlung beruhen unter anderem auf ihrer Rolle bei der Vitamin-D-Synthese durch UV-B-Strahlung und bei der Photochemotherapie mittels UV-A-Strahlung. Erhöhte UV-B-Strahlung gefährdet jedoch die Gesundheit von Lebewesen, da organische Moleküle wie Proteine und Nukleinsäuren diese absorbieren und dadurch geschädigt werden können.[119]
Das Ozonloch über der Antarktis war in einigen Fällen so groß, dass Teile Australiens, Neuseelands, Chiles, Argentiniens und Südafrikas betroffen waren. Im Jahr 2005 schwankte der UV-Index in Quito, der Hauptstadt von Ecuador, bei wolkenfreiem Himmel zwischen 14 und 20, wobei die Weltgesundheitsorganisation einen UV-Index über 11 als Gesundheitsrisiko betrachtet.[120][121] In Bolivien wurde in den Anden im Jahr 2003 an 61 Tagen eine extreme UV-B-Strahlung gemessen. Diese entsprach einem UV-Index von 43,3, dem höchsten jemals gemessenen Wert am Boden.[122]
Hautkrebs

Eine wesentliche Auswirkung des Ozonabbaus auf die menschliche Gesundheit ist die Zunahme der Hautkrebshäufigkeit. UV-B-Strahlung verursacht eine Schädigung der DNA durch die Bildung von Cyclobutan-Pyrimidin-Dimeren und Pyrimidin-Pyrimidon (6-4)-Photoprodukten oder durch die Produktion von reaktiven Sauerstoffspezies. Die Photoprodukte können durch den Nukleotidexzisionsreparaturweg erkannt und repariert werden. Die DNA-Reparaturproteine dieses Weges binden an die Stellen, an denen die DNA geschädigt ist, und aktivieren den Reparaturmechanismus. Störungen dieses Mechanismus stehen im Zusammenhang mit der Entstehung von Hautkrebs.[123]
Die US-Umweltschutzbehörde EPA schätzt, dass eine Zunahme der UV-B-Strahlung um 1 % zu einer Zunahme der Inzidenz von nicht-melanomem Hautkrebs um 2 bis 5 % sowie zu einer Zunahme von malignem Melanom-Hautkrebs führt.[41] In Deutschland lag der Anteil des malignen Melanoms an den häufigsten Krebsneuerkrankungen im Jahr 2020 bei Männern bei 4,7 %, bei Frauen war es mit 4,9 % die vierthäufigste Krebsart nach Brust-, Darm- und Lungenkrebs.[124] Bei den ermittelten Prozentzahlen wurden die Fälle von nicht-melanotischen Hautkrebs nicht berücksichtigt.
Nach Modellrechnungen der EPA wird die größte Inzidenzsteigerung bei Hautkrebs durch den stratosphärischen Ozonabbau für die Geburtsjahrgänge zwischen 1960 und 1980 erwartet. Diese Jahrgänge waren der höchsten kumulativen Lebenszeitdosis erhöhter UV-B-Strahlung ausgesetzt. Wegen des erwarteten Rückgangs des Ozonabbaus prognostizieren die Modellrechnungen für die nach 2040 geborenen Jahrgänge keine erhöhte Hautkrebsinzidenz.[123]
In Australien lag die Inzidenz von Hautkrebs im Jahr 2023 bei 80,6 für Männer und 51,5 für Frauen, während sie in Deutschland im Jahr 2020 bei 19,9 für Männer und 19,1 für Frauen lag.[125] Die hohe Inzidenz in Australien ist auf eine Kombination von überwiegend hellhäutiger Bevölkerung und hoher UV-Belastung zurückzuführen. Die Internationale Agentur für Krebsforschung (IARC) schätzt, dass Australien im Jahr 2020 die höchste altersstandardisierte Melanom-Inzidenz weltweit aufwies.[126]
Grauer Star

UV-Strahlung erhöht das Risiko von Katarakten, auch Grauer Star genannt, eine Eintrübung der Augenlinse, die weltweit die Hauptursache für Sehstörungen und Blindheit ist. Es gibt mehrere mögliche Ursachen für altersbedingte Katarakte, eine lebenslange Exposition gegenüber UV-B-Strahlung kann jedoch ein wichtiger Faktor sein, wobei jedoch nur der kortikale Katarakt im eindeutigen Zusammenhang mit der Exposition gegenüber UV-Strahlung steht.[127]
Im Jahr 2015 waren 35 % aller Erblindungen auf Katarakte zurückzuführen.[123] Es wird geschätzt, dass die Inzidenz von Katarakten um etwa 0,5 bis 0,6 % pro 1 % Gesamtozonabbau, ausgehend vom Niveau von 1980, zunimmt, was weltweit 100.000 bis 150.000 zusätzliche Fälle von Katarakt-bedingter Erblindung bedeuten würde.[128][50] Neben Katarakten können Plattenepithelkarzinome der Hornhaut und der Bindehaut auftreten.[127]
Immunsystem
Im Rahmen des Montreal-Protokolls wurde ein Bewertungsausschuss eingesetzt, der sich mit ökologischen Fragen im Zusammenhang mit dem Ozonabbau befasste. Der Ausschuss kam zu dem Schluss, dass die Exposition gegenüber erhöhter UV-Strahlung zu einer Unterdrückung des körpereigenen Immunsystems führen kann. UV-B-Strahlung deaktiviert einen Teil der Immunantwort, der von weißen Blutkörperchen gesteuert wird, und stimuliert die Produktion von regulatorischen T-Zellen, die die Immunabwehr unterdrücken.[50]
Tiererkrankungen

Die Schäferhundkeratitis ist eine entzündliche Erkrankung der Hornhaut, die besonders häufig bei Deutschen Schäferhunden, Border Collie, Windhund, Siberian Husky und Australian Shepherd und weiteren Rassen auftritt. Der genaue Entstehungsmechanismus ist ungeklärt, jedoch zeigen Tiere, die einer stärkeren UV-Strahlung ausgesetzt sind, schwerere klinische Symptome. Als Gegenmaßnahme wird unter anderem das Tragen von UV-Schutzbrillen zur Vermeidung längerer UV-Bestrahlung für betroffene Hunde empfohlen.[129]
Bei Walen vor der Küste Kaliforniens wurde ein starker Anstieg von epidermalen Schäden, die mit akutem und schwerem Sonnenbrand in Verbindung gebracht werden, festgestellt. Bei Hautbiopsien von über 150 Blau-, Finn- und Pottwalen im Golf von Kalifornien fanden sich Zellen, die sich bilden, wenn die DNA durch UV-Strahlung beschädigt wird. Die Ergebnisse deuten darauf hin, dass steigende UV-Strahlung als Folge des Ozonabbaus für die beobachteten Hautschäden verantwortlich sind.[130]
Studien deuten darauf hin, dass Fische, die erhöhter UV-Strahlung ausgesetzt sind, anfälliger für Infektionen durch Bakterien, Nematoden und Protozoen sind. Fische haben verschiedene Möglichkeiten entwickelt, um die Auswirkungen einer übermäßigen UV-Exposition abzuschwächen, etwa durch Pigmentierung oder die Wahl eines weniger UV-belasteten Lebensraums.[131]
Terrestrische Ökosysteme
Zu den terrestrischen Ökosystemen gehören landwirtschaftlich genutzte Flächen und Agrarlandschaften sowie Wälder, Grasland, Savannen, Wüsten und Tundren.[132] Eine Zunahme der UV-B-Strahlung wirkt sich in vielfältiger Weise auf die Vegetation aus. So wird die Photosynthese durch die Bildung von reaktiven Sauerstoffspezies beeinflusst, welche die Photosynthesepigmente zerstören. Neben der direkten Schädigung durch erhöhte eine UV-Strahlung führt diese auch zu einer Erhöhung der bodennahen Ozonkonzentration. Aufgrund seiner oxidierenden Wirkung kann dieses Ozon das Pflanzenwachstum hemmen.[50] Veränderungen in der Zersetzung von organischem Material wie Streu, dem Bestandsabfall der Vegetation, können die Verfügbarkeit von Nährstoffen für das Pflanzenwachstum beeinträchtigen. UV-Strahlung vermindert die biotische Abbaurate, während sie bei abiotischen Prozessen den Abbau eher fördert.[133]
Aquatische Ökosysteme
Die Funktionsfähigkeit der aquatischen Ökosysteme ist für das Leben auf der Erde von zentraler Bedeutung. Eine erhöhte UV-Strahlung hat nachweislich negative Auswirkungen auf aquatische Ökosysteme, wobei Organismen wie Phytoplankton, Zooplankton, Krebs- und Krabbenlarven und Jungfische besonders gefährdet sind. Der Rückgang des Phytoplanktons, das in vielen aquatischen Ökosystemen die Basis der Nahrungskette bildet, kann zu einer Verringerung der gesamten Biomasseproduktion führen. Da marines Phytoplankton Kohlenstoffdioxid absorbiert, würde ein Rückgang des Phytoplanktons dessen Aufnahme von Kohlenstoffdioxid verringern und damit die globale Erwärmung verstärken.[134]
Jedoch sind die Auswirkungen der UV-B-Strahlung auf die Gesamtstruktur und -funktionen aquatischer Ökosysteme nur wenig erforscht. Ein Rückgang der Populationsgröße eines UV-empfindlichen Primärproduzenten könnte gegebenenfalls durch die Zunahme der Populationsgröße einer UV-toleranteren Art kompensiert werden. Wie und ob sich diese möglichen strukturellen Veränderungen auswirken werden, ist nicht abschließend geklärt.[135]
Photodegradation von Baumaterialien

In der Bauindustrie werden Biopolymere wie Holz sowie industriell hergestellte Polymere verwendet. In Westeuropa und den USA wird etwa ein Drittel der produzierten Kunststoffe im Bauwesen und in der Landwirtschaft eingesetzt. Zu den Produkten, die regelmäßig dem Sonnenlicht ausgesetzt sind, gehören beispielsweise Bedachungsmaterialien, Kunststoff- oder Holzverkleidungen, Fensterrahmen und Kunststoffrohre. Diese Materialien werden durch eine erhöhte UV-B-Strahlung negativ beeinflusst und den Abbau dieser Materialien beschleunigen und ihre Lebensdauer verkürzen. Zwar könnten die betroffenen Materialien durch lichtstabilere Materialien ersetzt werden. Dies würde jedoch die Kosten in den betreffenden Anwendungen erhöhen und die finanzielle Belastung durch den Ozonabbau verstärken.[136]
Ein Indiz für UV-B-induzierte Oxidationsprozesse in Kunststoffen ist die Bildung von Carbonylgruppen, die ein wesentlicher Schritt beim Abbau dieser Materialien ist.
Dieser Prozess kann beispielsweise durch das Auftreten einer Carbonylbande im Infrarotspektrum nachgewiesen werden.[137]
Kunststoffe werden durch UV-Strahlung zu Mikroplastik und Nanoplastik abgebaut, aus Kunststoffen ausgelaugte Additive ebenfalls. Die Toxizität der Abbauprodukte ist nicht bekannt und die biologischen Auswirkungen sind unklar.[138]
Einfluss auf den Klimawandel
Der Klimawandel geschieht durch den Einfluss von Treibhausgasen auf das globale Klimasystem, während der Ozonabbau durch bestimmte Substanzen erfolgt. Ozonabbau und Klimawandel sind nicht die primäre Ursache des anderen, jedoch gibt es Bereiche, in denen sie miteinander in Verbindung stehen. Ein offensichtlicher Zusammenhang ist, dass es sich bei den ozonabbauenden Substanzen und Ozon selbst um Treibhausgase handelt. Die Absorption der von der Erde ausgehenden Infrarotstrahlung durch Ozon erfolgt sowohl in der Stratosphäre als auch in der Troposphäre und beeinflusst zusammen mit der Erwärmung der Stratosphäre durch UV-Absorption die Temperaturstruktur der Atmosphäre.[139]
Der Anstieg der Treibhausgaskonzentration ist eine wesentliche Ursache für die polare Verstärkung, das heißt, die im Vergleich zum globalen Mittel stärkere Erwärmung der arktischen Oberflächentemperatur. Klimamodellsimulationen zeigen, dass der Einfluss von ozonabbauenden Substanzen auf die Erwärmung der Arktis und der Verlust von Meereis etwa 52 % bis 59 % der Erwärmung durch Kohlenstoffdioxid ausmachen. Der Einfluss der ozonabbauenden Stoffe auf die Arktis geschieht dabei in erster Linie über die direkte Strahlungserwärmung und nicht über den Ozonabbau.[140] Verstärkt wird dieser Effekt durch rotpigmentierte Schneealgenblüten und Kryokonit-Granulate, die die Albedo verringern und das Abschmelzen der Eismassen beschleunigen.[141][142]

Die Brewer-Dobson-Zirkulation hat sich zwischen 1980 und 2018 mit einer relativen Zunahme von 1,7 % pro Jahrzehnt beschleunigt, wahrscheinlich aufgrund des durch Treibhausgase verursachten Klimawandels.[143] Eine Zunahme der stratosphärischen Ozonkonzentration in Verbindung mit einer beschleunigten Brewer-Dobson-Zirkulation führt möglicherweise zu einem Anstieg der globalen troposphärischen Ozonbelastung.[144]
Durch die beschleunigte Brewer-Dobson-Zirkulation gelangt mehr Wasserdampf und Methan in die Stratosphäre. Methan spielt eine wichtige Rolle in der Stratosphärenchemie, zum Beispiel durch die Bildung von Reservoirgasen wie Chlorwasserstoff. Der größte Teil des zusätzlichen Wasserdampfs oberhalb von etwa 20 Kilometern ist auf die Oxidation von Methan zurückzuführen. Wasserdampf ist eine Quelle für Hydroxyl-Radikale, die katalytisch Ozon abbauen und an vielen anderen Reaktionen in der Stratosphäre beteiligt sind. Darüber hinaus bildet er einen Hauptbestandteil der polaren Stratosphärenwolken, die eine wichtige Komponente des Ozonabbaus im Polarwirbel darstellen.[145]
Die Theorie des Klimawandels sagt eine Erwärmung der Troposphäre und eine Abkühlung der Stratosphäre voraus. Niedrigere Temperaturen in kalten Wintern begünstigen die Bildung von polaren Stratosphärenwolken, die wiederum den Ozonabbau fördern. Der vom Menschen verursachte Klimawandel kann daher die positiven Auswirkungen des Montreal-Protokolls auf den Schutz der Ozonschicht teilweise zunichtemachen.[146]
Messung von Ozon und anderen Spurengasen
Die Überwachung der Ozonkonzentration und die Bestimmung anderer Spurengase erfolgt mit Hilfe von Satelliten- und Flugzeuginstrumenten, Wetterballonsonden und bodengestützten Instrumenten. Bodenstationen überwachen die Ozonkonzentration mit Hilfe von Wetterballons, Lidar und Dobson-Spektrophotometern.[147] Zu den Standardmethoden für die Fernerkundung gehören weiterhin die Zweistrahl-UV-Absorptions-Ozonphotometrie, Fourier-Transform-Infrarotspektroskopie, die differentielle optische Absorptionsspektroskopie und die Mikrowellenradiometrie.[148] Die Übermittlung und die Verarbeitung der meteorologischen Daten erfolgt über das „Global Telecommunications System“, ein Netzwerk der Weltorganisation für Meteorologie.
Bodengestützte Messungen

Ein Dobson-Spektrophotometer ist ein bodengestütztes Instrument, das den Ozongehalt der Atmosphäre durch den Vergleich der UV-Lichtintensität bei Wellenlängen, die stark und schwach von Ozon absorbiert werden, bestimmt. Das Instrument misst in Dobson-Einheiten (DU), wobei 100 DU einer 1 Millimeter dicken Ozonschicht bei Standardtemperatur und -druck entsprechen.[149] Gordon Dobson baute Mitte der 1920er Jahre das erste Dobson-Spektrophotometer, um die Veränderungen der Ozonsäule zu untersuchen. Die frühesten kontinuierlichen Ozonbeobachtungen begannen 1925 in Arosa, Schweiz, durch Paul Götz. Diese Aufzeichnungen und eine Reihe anderer Langzeitmessungen lieferten die Basis für das Verständnis von Schwankungen der Ozonkonzentration vor Beginn des Ozonabbaus durch Fluorchlorkohlenwasserstoffe.[149]
Viele der von Dobson gebauten Instrumente sind noch im 21. Jahrhundert in Betrieb, ihre Genauigkeit, das heißt der Grad der Übereinstimmung der Messwerte mit dem wahren Wert, wird mit ±1 % angegeben. Die Präzision des Gerätes, das heißt die Messgenauigkeit, mit der wiederholte Messungen unter unveränderten Bedingungen die gleichen Ergebnisse liefern, wird mit 3 % angegeben. Sie ist schwieriger zu bestimmen, da sie neben gerätespezifischen Eigenschaften von den jeweiligen Beobachtungsbedingungen abhängt.[150]
Zur Messung von Konzentrationsprofilen atmosphärischer Aerosole oder von Gasen wie Wasserdampf und Ozon oder anderer Spurengase wie Schwefeldioxid, Stickoxide, Methan oder Chlorwasserstoff werden Lidar-Systeme eingesetzt, nach der englischen Bezeichnung „Light Detection and Ranging“ (Lichtdetektion und Abstandsmessung). Dies sind Instrumente, die die Atmosphäre mit einem gepulsten Laser abtasten. Das Laserlicht wird von Partikeln und Molekülen in der Atmosphäre zurückgestreut und die zurückgestreute Strahlung wird von einem Teleskop in der Nähe des Lasers aufgezeichnet.[151]
Dazu werden vorwiegend zwei Lidar-Typen eingesetzt, das Raman-Lidar und das Differential-Absorptions-Lidar (DIAL). Bei einem Raman-Lidar wird die Streuung des Laserstrahls mittels Raman-Streuung gemessen. Die durch diese Streuung verursachte Frequenzverschiebung ist für jedes Molekül charakteristisch und dient zum Nachweis seiner Konzentration.[152] DIAL-Systeme emittieren zwei Strahlen mit zwei unterschiedlichen Frequenzen. Während ein Strahl genau auf eine molekulare Absorptionslinie abgestimmt ist, ist der andere Strahl auf eine nahe gelegene Wellenlänge ohne molekulare Absorption abgestimmt. Anhand der unterschiedlichen Intensität des gestreuten Lichts bei den beiden Frequenzen können DIAL-Systeme den Anteil der einzelnen Moleküle in der Atmosphäre bestimmen. Weiterhin kann aus der Zeitdifferenz zwischen der Aussendung des Laserpulses und dem Eintreffen der rückgestreuten Photonen am Teleskop die Höhe des Rückstreuereignisses bestimmt werden.[153] Die Systeme lassen sich boden-, Flugzeug- oder satellitengestützt einsetzen.
Ballonmessungen

An Wetterballons angebrachte elektrochemische Ozonsonden können die Ozonkonzentration während des Ballonaufstiegs bis in Höhen von etwa 30 bis 35 Kilometern messen. Ozonsonden bestehen aus zwei Elektrolysezellen, die beide eine Kaliumiodidlösung enthalten. Die Luftprobe wird dazu durch die Kaliumiodidlösung gepumpt. Ozon reagiert mit Kaliumiodid in Gegenwart von Wasser zu Iod, Sauerstoff und Kaliumhydroxid.[154]
Wird das Gleichgewicht zwischen den Zellen durch die obige Reaktion gestört, fließt ein elektrischer Strom zwischen den beiden Zellen, wobei dieser proportional zum Ozonpartialdruck in der Luft ist. Der Vorteil dieser Messmethode ist, dass die Zelle sehr kompakt ist, nur wenige Milliliter Kaliumiodidlösung erfordert und entsprechende Geräte relativ kostengünstig hergestellt werden können. Ozonsonden liefern in Abhängigkeit von der Reaktionszeit der elektrochemischen Zelle, die etwa 20 bis 30 Sekunden beträgt, und einer Aufstiegsgeschwindigkeit des Ballons von etwa 6 Metern pro Sekunde beträgt die vertikale Auflösung der Ozonkonzentration etwa 150 Meter. Daneben sind Brewer-Mast-Sonden gebräuchlich, bei denen zwei Elektroden aus verschiedenen Metallen in eine gepufferte Kaliumiodidlösung getaucht werden. Die Messwerte werden von einer Radiosonde zusammen mit anderen Größen wie Luftdruck, Luftfeuchtigkeit und Lufttemperatur per Funk an die Bodenstation übertragen.[155][156]
Messungen aus Flugzeugen

In der unteren Stratosphäre wird eine Reihe von chemischen Messungen von Flugzeugen und Drohnen aus durchgeführt. Die NASA und die NOAA setzen dafür eine Reihe von hochfliegenden Flugzeugen und Drohnen ein, darunter zwei Spezialversionen der Lockheed U-2, die ER-2 (Earth Resources) und seit Oktober 2009 Drohen des Typs Global Hawk. Bereits Anfang der 1970er Jahre setzte die NASA zwei WB-57F Canberras, NASA 926 und NASA 928, für die Atmosphärenforschung in großer Höhe ein. Die Flughöhe beträgt etwa 20 Kilometer und die Reichweite liegt zwischen 4600 und etwa 18.500 Kilometern.[157]
Neben den meteorologischen Messungen lag ein Schwerpunkt der Untersuchungen auf der Messung photochemisch aktiver Gase. Ziel war es, die Vorgänge in den polaren Stratosphärenwolken und die daraus resultierenden heterogenen Prozesse zu untersuchen, die dem Ozonabbau in den Polarregionen zugrunde liegen. Weitere Untersuchungen befassten sich mit dem Einfluss von Vulkanausbrüchen und dem daraus resultierenden Schwefelsäureaerosol in der unteren Stratosphäre auf die Ozonchemie in den mittleren Breiten.[158]
Zu den verwendeten Instrumenten gehört ein Zweistrahl-UV-Absorptions-Ozonphotometer, bei dem die UV-C-Strahlung von 254 Nanometern einer Quecksilberdampflampe durch zwei identische Probenkammern geleitet wird, von denen eine die Probe der Umgebungsluft und die andere eine von Ozon gereinigte Probe enthält. Da Ozon bei einer Wellenlänge von 254 Nanometern stark absorbiert, kann die Konzentration aus der Differenz der in den beiden Kammern gemessenen Absorption mit einer Genauigkeit von besser als 5 % bestimmt werden.[159]
Satellitengestützte Messungen


Zu den gängigen Methoden der satellitengestützten Ozonbestimmung gehören die Messung der rückgestreuten Ultraviolettstrahlung, die Infrarotspektroskopie und die Okkultation. Bei der Okkultation wird die Erdatmosphäre durch die Bedeckung der Sonne oder von Sternen im ultravioletten, sichtbaren und nahen infraroten Bereich untersucht. Die stellare Okkultation erlaubt die Bestimmung der nächtlichen Verteilung von Spurengasen.[160]
Das erste Weltrauminstrument, das die Erdatmosphäre mit Hilfe der stellaren Okkultation analysierte war GOMOS (Global Ozone Monitoring by Occultation of Stars) an Bord des europäischen Satelliten Envisat, der von 2002 bis 2012 in Betrieb war. Ziel von GOMOS war es, die Verteilung des Ozons und anderer Substanzen wie Stickstoffdioxid, dem Nitrat-Radikal und Wasser in der mittleren Atmosphäre im Bereich von 15 bis 100 Kilometern Höhe zu ermitteln.[161]
Das mit dem Prinzip der rückgestreuten Ultraviolettstrahlung arbeitende Total Ozone Mapping Spectrometer wurde erstmals 1978 an Bord des NASA-Satelliten Nimbus-7 eingesetzt. Das TOMS-Instrument ermittelte die Ozonkonzentration, indem es bei sechs Wellenlängen zwischen 310 und 380 Nanometern die ultraviolette Strahlung der Sonne mit der von der Erde zum Satelliten zurückgestreuten Strahlung verglich. Insgesamt wurden zwischen 1978 und 1996 vier dieser Instrumente auf verschiedenen Satelliten, darunter ein russischer und ein japanischer, in die Erdumlaufbahn gebracht. Die letzte Mission endete 2006. Vor der Entwicklung des TOMS- und seines Vorgängerinstruments Backscatter UV (BUV), das bereits 1970 an Bord des Satelliten Nimbus-4 getestet wurde, wurden Ozonmessungen nur lokal mit Dobson-Spektrophotometern durchgeführt. Das TOMS-Instrument ermöglichte erstmals eine täglich aktualisierte Kartierung der globalen Ozonkonzentration.[162]
Als Nachfolger des TOMS-Instruments ist seit 2004 das „Ozone Monitoring Instrument“ (OMI), ein Spektrometer an Bord des Satelliten Aura, in Betrieb. Das Instrument misst die Verteilung von Aerosolen wie Rauch, Staub und Sulfattröpfchen sowie Gesamtozon und andere atmosphärische Parameter, die mit der Ozonchemie zusammenhängen.[163] Das Global Ozone Monitoring Experiment-2 (GOME-2) ist ein Instrument, das auf dem MetOp-Satelliten seit 2006 im Einsatz ist. Es misst die Konzentrationen von atmosphärischem Ozon sowie von Stickstoffdioxid, Schwefeldioxid, anderen Spurengasen und ultravioletter Strahlung.[164]
Literatur
- Reiner Grundmann: Transnationale Umweltpolitik zum Schutz der Ozonschicht. USA und Deutschland im Vergleich. Campus, Frankfurt (Main), New York, 1999, ISBN 3-593-36222-8.
- Peter Fabian: Leben im Treibhaus: unser Klimasystem – und was wir daraus machen. Springer, Heidelberg, New York, Hongkong, 2002, ISBN 978-3-642-62805-4.
- C.N. Hewitt, Andrea V. Jackson (Hrsg.): Handbook of Atmospheric Science. Principles and Applications. Blackwell Science, Malden, Oxford, Victoria, 2003, ISBN 0-632-05286-4.
- Guy P. Brasseur, Susan Solomon: Aeronomy of the Middle Atmosphere Chemistry and Physics of the Stratosphere and Mesosphere. Springer, Dordrecht, 2005, ISBN 978-1-4020-3284-4.
- Brigitte Klose, Heinz Klose: Meteorologie. Eine interdisziplinäre Einführung in die Physik der Atmosphäre. Springer, 2008, doi:10.1007/978-3-540-71309-8.
- Walter Roedel, Thomas Wagner: Physik unserer Umwelt: Die Atmosphäre. Springer, Berlin, Heidelberg, 2011, ISBN 978-3-642-15729-5.
- S. A. Abbasi, Tasneem Abbasi: Ozone Hole. Past, Present, Future. Springer Nature, New York, 2017, ISBN 978-1-4939-6708-7.
- World Meteorological Organization (WMO): Scientific Assessment of Ozone Depletion: 2022, GAW Report No. 278. WMO, Genf, 2022, ISBN 978-9914-733-97-6 (online).
- Environmental Effects Assessment Panel: Environmental Effects of Stratospheric Ozone Depletion, UV Radiation, and Interactions with Climate Change 2022 Assessment Report. UNEP Nairobi, Ozone Secretariat, 2023, ISBN 978-9914-733-91-4 (online).
Weblinks
Einzelnachweise
- Michael D. King (Hrsg.): The State of Science in the EOS Program (PDF; 6,6 MB) auf eospso.nasa.gov, abgerufen am 1. März 2024.
- NCCS Helps NASA Scientists Create New Global Ozone Profile Reaching from Earth’s Surface to the Mesosphere | NASA Center for Climate Simulation. In: nccs.nasa.gov. 31. Oktober 2002, abgerufen am 2. März 2024 (englisch).
- Martin Kappas: Klimatologie. Spektrum, Heidelberg, 2009, ISBN 978-3-8274-1827-2, S. 71–73.
- Guy P. Brasseur, Susan Solomon: Aeronomy of the Middle Atmosphere Chemistry and Physics of the Stratosphere and Mesosphere. Springer, Dordrecht, 2005, ISBN 978-1-4020-3284-4, S. 443–444.
- Stefan Brönnimann: Ozon in der Atmosphäre. Haupt, Bern, Stuttgart, Wien, 2002, ISBN 3-258-06437-7, S. 23.
- E. A. Ainsworth u. a.: The Effects of Tropospheric Ozone on Net Primary Productivity and Implications for Climate Change. In: Annual Review of Plant Biology. 63.1, 2012, S. 637–661, doi:10.1146/annurev-arplant-042110-103829.
- Bodennahes Ozon und Sommersmog. Informationsbroschüre des bayerischen Landesamts für Umwelt, (PDF-Datei) auf lfu.bayern.de, abgerufen am 2. März 2024.
- Ozon-Belastung | Umweltbundesamt. In: umweltbundesamt.de. Abgerufen am 2. März 2024.
- Brigitte Klose: Die Erdatmosphäre: Ihre chemische Zusammensetzung, vertikale Struktur und Physik. In: Brigitte Klose, Heinz Klose (Hrsg.): Meteorologie. Eine interdisziplinäre Einführung in die Physik der Atmosphäre. Springer, 2008, S. 21–22, doi:10.1007/978-3-540-71309-8.
- Martin Kappas: Klimatologie. Spektrum, Heidelberg, 2009, ISBN 978-3-8274-1827-2, S. 85–86.
- M. Dameris, T. Peter, U. Schmidt, R. Zellner: Das Ozonloch und seine Ursachen. In: Chemie in unserer Zeit. 41.3, 2007, S. 152–168, doi:10.1002/ciuz.200700418.
- Paul J. Crutzen: Tropospheric Ozone: An Overview. In: I. S. A. Isaksen (Hrsg.): Tropospheric Ozone. NATO ASI Series, Bd. 227. Springer, Dordrecht. ISBN 978-94-009-2913-5, S. 3–4.
- Rolf Müller: A brief history of stratospheric ozone research. In: Meteorologische Zeitschrift. 18.1, 2009, S. 3–24, doi:10.1127/0941-2948/2009/353
- U. Langematz: Stratospheric ozone: down and up through the anthropocene. In: ChemTexts. 5.2, 2019, doi:10.1007/s40828-019-0082-7.
- G. M. B. Dobson: Forty Years’ Research on Atmospheric Ozone at Oxford: a History. In: Applied Optics. 7.3, 1968, S. 387–405, doi:10.1364/ao.7.000387.
- Paul Götz, Rudolf Ladenburg: Ozongehalt der unteren Atmosphärenschichten. In: Die Naturwissenschaften. 19.18, 1931, S. 373–374, doi:10.1007/bf01516268.
- Reiner Grundmann: Transnationale Umweltpolitik zum Schutz der Ozonschicht. USA und Deutschland im Vergleich. Campus, Frankfurt, Main, New York, 1999, ISBN 3-593-36222-8, S. 149.
- J. Staehelin, P. Viatte, R. Stübi, F. Tummon, T. Peter: Stratospheric ozone measurements at Arosa (Switzerland): history and scientific relevance. In: Atmospheric Chemistry and Physics. 18.9, 2018, S. 6567–6584, doi:10.5194/acp-18-6567-2018.
- S. A. Abbasi, Tasneem Abbasi: Ozone Hole. Past, Present, Future. Springer Nature, New York, 2017, ISBN 978-1-4939-6708-7, S. 20–24.
- Carmen J. Giunta: Thomas Midgley, Jr., and The Invention of Chlorofluorocarbon Refrigerants: It ain´t necessarily so. In: Bulletin for the History of Chemistry. 31.2, 2006, S. 66–74 (online).
- Charles F. Kettering: Biographical memoir of Thomas Midgley, Jr., 1889-1944. In: Biographical Memoirs, National Academy of Sciences. 24, 1947, S. 361–380, (PDF; online).
- Frank T. Edelmann: The life and legacy of Thomas Midgley Jr. In: Papers and Proceedings of the Royal Society of Tasmania. 150.1, 2016, S. 45–49, doi: 10.26749/rstpp.150.1.45.
- J. E. Lovelock: Atmospheric turbidity and CCl3F concentrations in rural Southern England and Southern Ireland. In: Atmospheric Environment (1967). 6.12, 1972, S. 917–925, doi:10.1016/0004-6981(72)90100-x.
- J. E. Lovelock, R. J. Maggs, R. J. Wade: Halogenated Hydrocarbons in and over the Atlantic. In: Nature. 241.5386, 1973, S. 194–196, doi:10.1038/241194a0.
- R. S. Stolarski, R. J. Cicerone: Stratospheric Chlorine: a Possible Sink for Ozone. In: Canadian Journal of Chemistry. 52.8, 1974, S. 1610–1615, doi:10.1139/v74-233.
- S. C. Wofsy, M. B. McElroy, Y. L. Yung: The chemistry of atmospheric bromine. In: Geophysical Research Letters. 2.6, 1975, S. 215–218, doi:10.1029/gl002i006p00215.
- Mario J. Molina, F. Sherwood Rowland: Stratospheric sink for chlorofluoromethanes: chlorine atom-catalysed destruction of ozone. In: Nature. 249, 1974, S. 810–812, doi:10.1038/249810a0
- David Doniger, Michelle Quibell: Back from the Brink: How NRDC Helped Save the Ozone Layer. In: nrdc.org. 13. September 2007, abgerufen am 1. März 2024 (englisch).
- The Nobel Prize in Chemistry 1995. In: nobelprize.org. 6. März 2024, abgerufen am 6. März 2024 (englisch).
- J. C. Farman, B. G. Gardiner, J. D. Shanklin: Large losses of total ozone in Antarctica reveal seasonal ClOx/NOx interaction. In: Nature. 315.6016, 1985, S. 207–210, doi:10.1038/315207a0.
- Ross J. Salawitch u. a.: 20 Questions & Answers about the Ozone Layer. 2022 Update. World Meteorological Organization, United Nations Environment Programme, National Oceanic and Atmospheric Administration, National Aeronautics and Space Administration, European Commission (Hrsg.), 2023, ISBN 978-9914-733-98-3 (online), S. 29.
- Stefan Brönnimann: Ozon in der Atmosphäre. Haupt, Bern, Stuttgart, Wien, 2002, ISBN 3-258-06437-7, S. 143.
- I. Tritscher u. a.: Polar Stratospheric Clouds: Satellite Observations, Processes, and Role in Ozone Depletion. In: Reviews of Geophysics. 59.2, 2021, doi:10.1029/2020rg000702.
- J. Staehelin, N. R. P. Harris, C. Appenzeller, J. Eberhard: Ozone trends: A review. In: Reviews of Geophysics. 39.2, 2001, S. 231–290, doi:10.1029/1999rg000059.
- NASA Leads Study of Unprecedented Arctic Ozone Loss. In: jpl.nasa.gov. 2. Oktober 2011, abgerufen am 23. März 2024 (englisch).
- Guy P. Brasseur, Susan Solomon: Aeronomy of the Middle Atmosphere Chemistry and Physics of the Stratosphere and Mesosphere. Springer, Dordrecht, 2005, ISBN 978-1-4020-3284-4, S. 397–398.
- M. Dameris: Klimawandel und die Chemie der Atmosphäre – wie wird sich die stratosphärische Ozonschicht entwickeln? In: Angewandte Chemie. 122.44, 2010, S. 8268–8279, doi:10.1002/ange.201001643.
- J. Bian: Features of ozone mini-hole events over the Tibetan Plateau. In: Advances in Atmospheric Sciences. 26, 2009, S. 305–311, doi:10.1007/s00376-009-0305-8.
- Q. Schiermeier: Solar wind hammers the ozone layer. In: Nature. 2005, doi:10.1038/news050228-12.
- B.M. Sinnhuber u. a.: Arctic winter 2010/2011 at the brink of an ozone hole. In: Geophysical Research Letters. 38, L24814, 2011, doi:10.1029/2011GL049784.
- Peter M. Morrisette: The Evolution of Policy Responses to Stratospheric Ozone Depletion. In: Natural Resources Journal. 29.3, 1989, S. 793–820, JSTOR:24883500
- Harold S. Johnston: Reduction of Stratospheric Ozone by Nitrogen Oxide Catalysts from Supersonic Transport Exhaust. In: Science. 173.3996, 1971, S. 517–522, doi:10.1126/science.173.3996.517, JSTOR:1732244.
- A. J. Broderick: Stratospheric Effects from Aviation. In: Journal of Aircraft. 15.10, 1978, S. 643–653, doi:10.2514/3.58423.
- Reiner Grundmann: Technische Problemlösung, Verhandeln und umfassende Problemlösung. In: Raymund Werle, Uwe Schimank (Hrsg.): Gesellschaftliche Komplexität und kollektive Handlungsfähigkeit. Campus, Frankfurt, New York, 2000, ISBN 3-593-36470-0, S. 165.
- Timeline of Stratospheric Ozone Depletion and Observations, (PDF; 2,2 MB) auf nasa.gov, abgerufen am 19. März 2024.
- World Meteorological Organization and United Nations Environment Programme: Plan of Action on the Ozone Layer. In: gml.noaa.gov. Abgerufen am 1. März 2024.
- Bundesumweltministerium: BMUV: Wiener Übereinkommen zum Schutz der Ozonschicht | Gesetze und Verordnungen. In: bmuv.de. 13. Januar 2017, abgerufen am 1. März 2024.
- William L. Ascher, Natalia Mirovitskaya: Guide to Sustainable Development and Environmental Policy. Duke University Press, 2002, ISBN 978-0-8223-8103-7, S. 348–350.
- Frederike Albrecht, Charles F. Parker: Healing the Ozone Layer. The Montreal Protocol and the Lessons and Limits of a Global Governance Success Story. In: Paul 't Hart, Mallory E. Compton (Hrsg.): Great Policy Successes. Oxford University Press, Oxford, 2019, ISBN 978-0-19-884371-9, S. 304–319.
- S. A. Abbasi, Tasneem Abbasi: Ozone Hole. Past, Present, Future. Springer Nature, New York, 2017, ISBN 978-1-4939-6708-7, S. 29–33.
- Greg Whitesides: Learning from Success: Lessons in Science and Diplomacy from the Montreal Protocol. In: Science & Diplomacy. 9.2, 2020, (online).
- Ozone Secretariat: Handbook for the Montreal Protocol on Substances that Deplete the Ozone Layer. The Secretariat for the Vienna Convention for the Protection of the Ozone Layer and for the Montreal Protocol on Substances that Deplete the Ozone Layer, United Nations Environment Programme, 2020, ISBN 978-9966-076-79-3, S. 6–14.
- P. J. Young u. a.: The Montreal Protocol protects the terrestrial carbon sink. In: Nature. 596.7872, 2021, S. 384–388, doi:10.1038/s41586-021-03737-3.
- United Nations Environment Programme: Annual Report 2010. UNEP Division of Communications and Public Information, 2011, ISBN 978-92-807-3149-1, S. 35.
- World Meteorological Organization (WMO): Scientific Assessment of Ozone Depletion: 2022, GAW Report No. 278. WMO, Genf, 2022, ISBN 978-9914-733-97-6, S. 194–197, (online).
- World Meteorological Organization (WMO): Scientific Assessment of Ozone Depletion: 2022, GAW Report No. 278. WMO, Genf, 2022, ISBN 978-9914-733-97-6, S. 79–84, (online).
- World Meteorological Organization (WMO): Scientific Assessment of Ozone Depletion: 2022, GAW Report No. 278. WMO, Genf, 2022, ISBN 978-9914-733-97-6, S. 32–33, (online).
- Ross J. Salawitch u. a.: 20 Questions & Answers about the Ozone Layer. 2022 Update. World Meteorological Organization, United Nations Environment Programme, National Oceanic and Atmospheric Administration, National Aeronautics and Space Administration, European Commission (Hrsg.), 2023, ISBN 978-9914-733-98-3 (online), S. 20–22.
- Verordnung (EG) Nr. 1005/2009
- A. J. Sicard, R. T. Baker: Fluorocarbon Refrigerants and their Syntheses: Past to Present. In: Chemical Reviews. 120.17, 2020, S. 9164–9303, doi:10.1021/acs.chemrev.9b00719.
- M. Aufhammer, B. J. Morzuch, J. K. Stranlund: Production of Chlorofluorocarbons in Anticipation of the Montreal Protocol. In: Environmental and Resource Economics. 30, 2005, S. 377–391, doi:10.1007/s10640-004-4222-0.
- P. J. Fraser u. a.: Australian chlorofluorocarbon (CFC) emissions: 1960–2017. In: Environmental Chemistry. 17.8, 2020, S. 525–544, doi:10.1071/en19322.
- Peter S. Connell, Donald J. Wuebbles: Evaluating CFC Alternatives from the Atmospheric Viewpoint. Paper, 82nd APCA Annual Meeting and Exhibition, Anaheim, California, June 25–30, 1989, (online).
- Sven Baumann u. a.: 1987 – 2017: 30 Jahre Montrealer Protokoll. Vom Ausstieg aus den FCKW zum Ausstieg aus teilfluorierten Kohlenwasserstoffen. Umweltbundesamt (Hrsg.), Fachgebiet III 1.4 Stoffbezogene Produktfragen, 2017 (online, PDF).
- Global Warming Potential (GWP) of certain substances and mixtures | Umweltbundesamt. In: umweltbundesamt.de. 1. Januar 2015, abgerufen am 18. März 2024.
- Thomas F. Stocker u. a. (Hrsg.): Climate Change 2013.The Physical Science Basis. Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press, New York, 2013, ISBN 978-1-107-05799-9, S. 731.
- Robert E. Tapscott: Commercialized Halon Options (PDF; 0,8 MB) auf nist.gov.
- Umweltbundesamt: Kühlgeräte mit FCKW. Immer ein Problem. Mai 2009 (PDF; 0,2 MB) auf umweltbundesamt.de, abgerufen am 2. März 2024.
- J. Tollefson: Illegal CFC emissions have stopped since scientists raised alarm. In: Nature. 590.7846, 2021, S. 373, doi:10.1038/d41586-021-00360-0.
- World Meteorological Organization (WMO): Scientific Assessment of Ozone Depletion: 2022, GAW Report No. 278. WMO, Genf, 2022, ISBN 978-9914-733-97-6, S. 57–60, (online).
- W. B. Thomas: Methyl bromide: effective pest management tool and environmental threat. In: Journal of Nematology. 28.4, 1996, S. 586–589, PMID 19277178.
- Hamish Cardwell: EPA decision allows for at least 13 more years of methyl bromide use | RNZ News. In: rnz.co.nz. 18. August 2021, abgerufen am 1. März 2024 (englisch).
- A. R. Ravishankara, J. S. Daniel, R. W. Portmann: Nitrous Oxide (N2O): The Dominant Ozone-Depleting Substance Emitted in the 21st Century. In: Science. 326.5949, 2009, S. 123–125, doi:10.1126/science.1176985.
- H. Tian u. a.: A comprehensive quantification of global nitrous oxide sources and sinks. In: Nature. 586.7828, 2020, S. 248–256, doi:10.1038/s41586-020-2780-0.
- E. Charlesworth u. a.: Stratospheric water vapor affecting atmospheric circulation. In: Nature Communications. 14.1, 2023, doi:10.1038/s41467-023-39559-2.
- F. Laturnus: Bildung und Abgabe kurzkettiger halogenierter Kohlenwasserstoffe durch Makroalgen der Polarregionen. In: Berichte zur Polarforschung. Alfred-Wegener-Institut für Polar- und Meeresforschung, 1993, S. 8–11, doi:10.2312/BZP_0132_1993.
- A. Mellouki, Ranajit K. Talukdar, Anne-Marie Schmoltner, Tomasz Gierczak, Michael J. Mills, Susan Solomon, A. R. Ravishankara: Atmospheric lifetimes and ozone depletion potentials of methyl bromide (CH3Br) and dibromomethane (CH2Br2). In: Geophysical Research Letters. 19.20, 1992, S. 2059–2062, doi:10.1029/92gl01612.
- Leibniz-Institut Für Meereswissenschaften: Emissionen kurzlebiger Bromverbindungen im tropischen Westpazifik, ihrer Quellen und ihr Eintrag in die Stratosphäre: TransBrom Sonne (01.07.2009 - 28.02.2011); Forschungsexpedition mit RV Sonne 9. bis zum 24. Oktober 2009 Tomakomai (Japan) bis Townsville (Australien); Abschlussbericht zum Projektantrag (1.0). Leibniz-Institut für Meereswissenschaften Kiel, IFM-GEOMAR, S. 20, doi:10.2314/GBV:68527957X.
- Rolf Müller: Stratospheric Ozone Depletion and Climate Change. Royal Society of Chemistry, Cambridge, 2012, ISBN 978-1-84973-002-0, S. 84–85.
- World Meteorological Organization (WMO): Scientific Assessment of Ozone Depletion: 2022, GAW Report No. 278. WMO, Genf, 2022, ISBN 978-9914-733-97-6, S. 86–91, (online).
- Martin Kappas: Klimatologie. Spektrum, Heidelberg, 2009, ISBN 978-3-8274-1827-2, S. 177.
- Guy P. Brasseur, Susan Solomon: Aeronomy of the Middle Atmosphere Chemistry and Physics of the Stratosphere and Mesosphere. Springer, Dordrecht, 2005, ISBN 978-1-4020-3284-4, S. 473.
- Ross J. Salawitch u. a.: 20 Questions & Answers about the Ozone Layer. 2022 Update. World Meteorological Organization, United Nations Environment Programme, National Oceanic and Atmospheric Administration, National Aeronautics and Space Administration, European Commission (Hrsg.), 2023, ISBN 978-9914-733-98-3 (online), S. 14.
- Stefan Brönnimann: Ozon in der Atmosphäre. Haupt, Bern, Stuttgart, Wien, 2002, ISBN 3-258-06437-7, S. 33–34.
- Guy P. Brasseur, Susan Solomon: Aeronomy of the Middle Atmosphere Chemistry and Physics of the Stratosphere and Mesosphere. Springer, Dordrecht, 2005, ISBN 978-1-4020-3284-4, S. 11.
- A. Robert Mackenzie: Stratospheric Chemistry and Transport. In: C.N. Hewitt, Andrea V. Jackson (Hrsg.): Handbook of Atmospheric Science. Principles and Applications. Blackwell Science, Malden, Oxford, Victoria, 2003, ISBN 0-632-05286-4, S. 201–202.
- Walter Roedel, Thomas Wagner: Atmosphärische Spurengase. In: Walter Roedel, Thomas Wagner: Physik unserer Umwelt: Die Atmosphäre. Springer, Berlin, Heidelberg, 2011, ISBN 978-3-642-15729-5, S. 403–412.
- Susan Solomon: Stratospheric ozone depletion: A review of concepts and history. In: Reviews of Geophysics. 37.3, 1999, S. 275–316, doi:10.1029/1999rg900008.
- William R. Stockwell: Atmospheric Chemistry. In: Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, 2017, doi:10.1002/0471238961.0120131518211919.a01.pub2, S. 5.
- Guy P. Brasseur, Susan Solomon: Aeronomy of the Middle Atmosphere Chemistry and Physics of the Stratosphere and Mesosphere. Springer, Dordrecht, 2005, ISBN 978-1-4020-3284-4, S. 364–367.
- Guy P. Brasseur, Susan Solomon: Aeronomy of the Middle Atmosphere Chemistry and Physics of the Stratosphere and Mesosphere. Springer, Dordrecht, 2005, ISBN 978-1-4020-3284-4, S. 327–329.
- Guy P. Brasseur, Susan Solomon: Aeronomy of the Middle Atmosphere Chemistry and Physics of the Stratosphere and Mesosphere. Springer, Dordrecht, 2005, ISBN 978-1-4020-3284-4, S. 311.
- F. S. Rowland: Stratospheric ozone depletion. In: Philosophical Transactions of the Royal Society. B: Biological Sciences. 361.1469, 2006, S. 769–790, doi:10.1098/rstb.2005.1783.
- Guy P. Brasseur, Susan Solomon: Aeronomy of the Middle Atmosphere Chemistry and Physics of the Stratosphere and Mesosphere. Springer, Dordrecht, 2005, ISBN 978-1-4020-3284-4, S. 405–410.
- Ross J. Salawitch u. a.: 20 Questions & Answers about the Ozone Layer. 2022 Update. World Meteorological Organization, United Nations Environment Programme, National Oceanic and Atmospheric Administration, National Aeronautics and Space Administration, European Commission (Hrsg.), 2023, ISBN 978-9914-733-98-3 (online), S. 25.
- Guy P. Brasseur, Susan Solomon: Aeronomy of the Middle Atmosphere Chemistry and Physics of the Stratosphere and Mesosphere. Springer, Dordrecht, 2005, ISBN 978-1-4020-3284-4, S. 27–28.
- Peter Fabian: Leben im Treibhaus: unser Klimasystem – und was wir daraus machen. Springer, Heidelberg, New York, Hongkong, 2002, ISBN 978-3-642-62805-4, S. 41–43.
- N. Butchart: The Brewer‐Dobson circulation. In: Reviews of Geophysics. 52.2, 2014, S. 157–184, doi:10.1002/2013rg000448.
- A. R. Ravishankara, D. R Hanson: Chemistry in Sulfate Aerosols. In: Geert K. Moortgat, Austin J. Barnes, Georges Le Bras, John R. Sodeau (Hrsg.): Low-Temperature Chemistry of the Atmosphere. Proceedings of the NATO Advanced Study Institute on Low-Temperature Chemistry of the Atmosphere, held at Maratea, Italy, August 29 – September 11, 1993. Springer, Berlin, Heidelberg, New York, London, Paris, Tokyo, Hong Kong, Barcelona, Budapest, 1994, ISBN 978-3-642-79065-2, S. 287–306.
- Martin Kappas: Klimatologie. Spektrum, Heidelberg, 2009, ISBN 978-3-8274-1827-2, S. 213–214.
- E. Arijs, D. Nevejans, J. Ingels, P. Frederick: Recent stratospheric negative ion composition measurements between 22‐ and 45‐km altitude. In: Journal of Geophysical Research: Atmospheres. 90.D4, 1985, S. 5891–5896, doi:10.1029/jd090id04p05891.
- Alan Robock: Mount Pinatubo as a Test of Climate Feedback Mechanisms. In: Alan Robock, Clive Oppenheimer (Hrsg.): Volcanism and the Earth's Atmosphere. Geophysical Monograph 139. American Geophysical Union, Washington, ISBN 0-87590-998-1, S. 1–8.
- C. M. Vidal u. a.: The 1257 Samalas eruption (Lombok, Indonesia): the single greatest stratospheric gas release of the Common Era. In: Scientific Reports. 6.1, 2016, doi:10.1038/srep34868.
- NASA Langley Research Center: Global Effects of Mount Pinatubo. In: earthobservatory.nasa.gov. 15. Juni 2001, abgerufen am 17. März 2024 (englisch).
- Peter Fabian: Leben im Treibhaus: unser Klimasystem – und was wir daraus machen. Springer, Heidelberg, New York, Hongkong, 2002, ISBN 978-3-642-62805-4, S. 118–120.
- Guy P. Brasseur, Susan Solomon: Aeronomy of the Middle Atmosphere Chemistry and Physics of the Stratosphere and Mesosphere. Springer, Dordrecht, 2005, ISBN 978-1-4020-3284-4, S. 493–494.
- S. Evan u. a.: Rapid ozone depletion after humidification of the stratosphere by the Hunga Tonga Eruption. In: Science. 382.6668, 2023, doi:10.1126/science.adg2551.
- The 2019 ozone hole is the smallest ever recorded | National Oceanic and Atmospheric Administration. In: noaa.gov. 21. Oktober 2019, abgerufen am 8. März 2024 (englisch).
- E. L. Fleming, P. A. Newman, Q. Liang, L. D. Oman: Stratospheric Temperature and Ozone Impacts of the Hunga Tonga‐Hunga Ha’apai Water Vapor Injection. In: Journal of Geophysical Research: Atmospheres. 129.1, 2024, doi:10.1029/2023jd039298.
- S. E. Grasby, D. P. G. Bond: How Large Igneous Provinces Have Killed Most Life on Earth—Numerous Times. In: Elements. 19.5, 2023, S. 276–281, doi:10.2138/gselements.19.5.276.
- David P. G. Bond, Yadong Sun: Global Warming and Mass Extinctions Associated With Large Igneous Province Volcanism. In: Richard E. Ernst, Alexander J. Dickson, Andrey Bekker (Hrsg.): Large Igneous Provinces: A Driver of Global Environmental and Biotic Changes, Geophysical Monograph 255, First Edition. American Geophysical Union und John Wiley and Sons, 2021, S. 85, doi: 10.1002/9781119507444.ch3.
- A. Ansmann u. a.: Ozone depletion in the Arctic and Antarctic stratosphere induced by wildfire smoke. In: Atmospheric Chemistry and Physics. 22.17, 2022, S. 11701–11726, doi:10.5194/acp-22-11701-2022.
- The International Ozone Commission, on the 35th anniversary of the Montreal Protocol, reports new milestones in documenting ozone layer recovery, 16. September 2022, (PDF; 0,1 MB) auf io3c.org, abgerufen am 1. März 2024.
- World Meteorological Organization (WMO): Scientific Assessment of Ozone Depletion: 2022, GAW Report No. 278. WMO, Genf, 2022, ISBN 978-9914-733-97-6, S. 168, (online).
- Peter Fabian: Leben im Treibhaus: unser Klimasystem – und was wir daraus machen. Springer, Heidelberg, New York, Hongkong, 2002, ISBN 978-3-642-62805-4, S. 176–178.
- Deutsches Institut für Normung (Hrsg.): Strahlungsphysik im optischen Bereich und Lichttechnik; Benennung der Wellenlängenbereiche. DIN 5031 Teil 7, Januar 1984.
- R. R. Jones: Ozone depletion and its effects on human populations. In: British Journal of Dermatology . 127.S41, 1992, S. 2–6, doi:10.1111/j.1365-2133.1992.tb16980.x, PMID 1390182.
- Kshama Rai, S.B. Agrawal: Effects of UV-B Radiation on morphological, physiological and biochemical Aspects of Plants: an Overview. In: Journal of Scientific Research. 61, 2017, S. 87–113 (online)
- Sunita Kataria, Madhya Pradesh (Hrsg.): UV-B Radiation and Crop Growth. Springer Nature, Singapore, 2022, ISBN 978-981-19-3619-7, S. 44.
- J. Herman u. a.: Global distribution and 14-year changes in erythemal irradiance, UV atmospheric transmission, and total column ozone for 2005–2018 estimated from OMI and EPIC observations. In: Atmospheric Chemistry and Physics. 20.14, 2020, S. 8351–8380, doi:10.5194/acp-20-8351-2020.
- Wetter und Klima - Deutscher Wetterdienst - Informationen - Erklärungen. In: dwd.de. Abgerufen am 8. März 2024.
- N. A. Cabrol u. a.: Record solar UV irradiance in the tropical Andes. In: Frontiers in Environmental Science. 2, 2014, doi:10.3389/fenvs.2014.00019.
- R. E. Neale u. a.: Environmental effects of stratospheric ozone depletion, UV radiation, and interactions with climate change: UNEP Environmental Effects Assessment Panel, Update 2020. In: Photochemical & Photobiological Sciences. 20.1, 2021, S. 1–67, doi:10.1007/s43630-020-00001-x.
- Robert-Koch-Institut: Krebs – Krebsarten. In: krebsdaten.de. 7. Dezember 2023, abgerufen am 1. März 2024.
- Robert-Koch-Institut: Krebs - Malignes Melanom der Haut. In: krebsdaten.de. 7. Dezember 2023, abgerufen am 11. März 2024.
- Cancer Council: Incidence and mortality | National Cancer Prevention Policy Skin Cancer Statistics and Issues. In: cancer.org.au. Abgerufen am 9. März 2024 (englisch).
- S. Madronich u. a.: Estimation of Skin and Ocular Damage Avoided in the United States through Implementation of the Montreal Protocol on Substances that Deplete the Ozone Layer. In: ACS Earth and Space Chemistry. 5.8, 2021, S. 1876–1888, doi:10.1021/acsearthspacechem.1c00183.
- Frank R. de Gruijl, Jan C. van der Leun: Environment and health: 3. Ozone depletion and ultraviolet radiation. In: CMAJ. 163.7, 2000, S. 851–855, PMID 11033716.
- Daniel Uribe-Castillo: Chronic Superficial Keratitis. In: Veterinaria y Zootecnía. 13.2, 2019, S. 24–30, doi:10.17151/vetzo.2019.13.2.3. (online)
- L. M. Martinez-Levasseur u. a.: Acute sun damage and photoprotective responses in whales. In: Proceedings of the Royal Society B: Biological Sciences. 278.1711, 2010, S. 1581–1586, doi:10.1098/rspb.2010.1903.
- K. P. Lawrence, A. R. Young, B. L. Diffey, M. Norval: The impact of solar ultraviolet radiation on fish: Immunomodulation and photoprotective strategies. In: Fish and Fisheries. 21.1, 2019, S. 104–119, doi:10.1111/faf.12420.
- Sunita Kataria, Madhya Pradesh (Hrsg.): UV-B Radiation and Crop Growth. Springer Nature, Singapore, 2022, ISBN 978-981-19-3619-7, S. 5.
- M. M. Caldwell u. a.: Terrestrial ecosystems, increased solar ultraviolet radiation, and interactions with other climate change factors. In: Photochemical and Photobiological Sciences. 6.3, 2007, S. 252–266, doi:10.1039/b700019g.
- R. E. Neale u. a.: The response of aquatic ecosystems to the interactive effects of stratospheric ozone depletion, UV radiation, and climate change. In: Photochemical and Photobiological Sciences. 22.5, 2023, S. 1093–1127, doi: 10.1007/s43630-023-00370-z.
- D. P. Häder, E. W. Helbling, C. E. Williamson, R. C. Worrest: Effects of UV radiation on aquatic ecosystems and interactions with climate change. In: Photochemical and Photobiological Sciences. 10.2, 2011, S. 242–260, doi:10.1039/c0pp90036b.
- A. L. Andrady, H. S. Hamid, A. Torikai: Effects of climate change and UV-B on materials. In: Photochemical and Photobiological Sciences. 2.1, 2003, S. 68–72, doi:10.1039/b211085g.
- M. C. Celina, E. Linde, E. Martinez: Carbonyl Identification and Quantification Uncertainties for Oxidative Polymer Degradation. In: Polymer Degradation and Stability. 188, 2021, S. 109550, doi:10.1016/j.polymdegradstab.2021.109550.
- Environmental Effects Assessment Panel: Environmental Effects of Stratospheric Ozone Depletion, UV Radiation, and Interactions with Climate Change 2022 Assessment Report. UNEP Nairobi, Ozone Secretariat, 2023, ISBN 978-9914-733-91-4, S. 339.
- Ozone Depletion and Climate Change – Defra, UK. In: uk-air.defra.gov.uk. Abgerufen am 25. März 2024 (englisch).
- L. M. Polvani u. a.: Substantial twentieth-century Arctic warming caused by ozone-depleting substances. In: Nature Climate Change. 10.2, 2020, S. 130–133, doi:10.1038/s41558-019-0677-4.
- S. Lutz u. a.: The biogeography of red snow microbiomes and their role in melting arctic glaciers. In: Nature Communications. 7.1, 2016, S. 1–9, doi:10.1038/ncomms11968.
- O. Meinander u. a.: Newly identified climatically and environmentally significant high-latitude dust sources. In: Atmospheric Chemistry and Physics. 22.17, 2022, S. 11889–11930, doi:10.5194/acp-22-11889-2022.
- Q. Fu, S. Solomon, H. A. Pahlavan, P. Lin: Observed changes in Brewer–Dobson circulation for 1980–2018. In: Environmental Research Letters. 14.11, 2019, S. 114026, doi:10.1088/1748-9326/ab4de7.
- World Meteorological Organization (WMO): Scientific Assessment of Ozone Depletion: 2022, GAW Report No. 278. WMO, Genf, 2022, ISBN 978-9914-733-97-6, S. 277, (online).
- S. Noël u. a.: Water vapour and methane coupling in the stratosphere observed using SCIAMACHY solar occultation measurements. In: Atmospheric Chemistry and Physics. 18.7, 2018, S. 4463–4476, doi:10.5194/acp-18-4463-2018.
- P. W. Barnes u. a.: Environmental effects of stratospheric ozone depletion, UV radiation, and interactions with climate change: UNEP Environmental Effects Assessment Panel, Update 2021. In: Photochemical and Photobiological Sciences. 21.3, 2022, S. 275–301, doi:10.1007/s43630-022-00176-5.
- Martin Kappas: Klimatologie. Spektrum, Heidelberg, 2009, ISBN 978-3-8274-1827-2, S. 15–21.
- Thomas Foken (Hrsg.): Springer Handbook of Atmospheric Measurements. Springer Nature, Cham, 2021, ISBN 978-3-030-52170-7, S. 799
- The Dobson Spectrophotometer. In: ozonelayer.noaa.gov. 20. März 2008, abgerufen am 1. März 2024.
- S. E. Nichol: Dobson spectrophotometer #17. In: Weather and Climate. 38.1, 2018, S. 16–25, doi:10.2307/26779361, JSTOR:26779361.
- Thomas Foken (Hrsg.): Springer Handbook of Atmospheric Measurements. Springer Nature, Cham, 2021, ISBN 978-3-030-52170-7, S. 684–697
- Ulla Wandinger: Raman Lidar. In: Claus Weitkamp: Lidar: Range-Resolved Optical Remote Sensing of the Atmosphere. Springer, New York, 2005, ISBN 978-0-387-40075-4, S. 241–271.
- R. De Young: Aircraft and Space Atmospheric Measurements Using Differential Absorption Lidar (DIAL). In: J. Orcutt (Hrsg.): Earth System Monitoring. Springer, New York, 2013, doi:10.1007/978-1-4614-5684-1_3, S. 35–61.
- Ozonesonde. In: ozonelayer.noaa.gov. 20. März 2008, abgerufen am 20. Februar 2024.
- ESRL Global Monitoring Laboratory - Ozone and Water Vapor. In: gml.noaa.gov. Abgerufen am 20. Februar 2024 (englisch).
- R. Van Malderen u. a.: Fifty years of balloon-borne ozone profile measurements at Uccle, Belgium: a short history, the scientific relevance, and the achievements in understanding the vertical ozone distribution. In: Atmospheric Chemistry and Physics. 21.16, 2021, S. 12385–12411, doi:10.5194/acp-21-12385-2021.
- Robert E. Curry: NASA Airborne Science Program: NASA Stratospheric Platforms. 2010 International Conference on Airborne Research for the Environment (ICARE). No. DFRC-E-DAA-TN2387. 2010. (online)
- A. F. Tuck, W. H. Brune, R. S. Hipskind: Airborne Southern Hemisphere Ozone Experiment/Measurements for Assessing the Effects of Stratospheric Aircraft (ASHOE/MAESA): A road map. In: Journal of Geophysical Research: Atmospheres. 102.D3, 1997, S. 3901–3904, doi:10.1029/96jd02745.
- R. S. Gao : A compact, fast UV photometer for measurement of ozone from research aircraft. In: Atmospheric Measurement Techniques. 5.9, 2012, S. 2201–2210, doi:10.5194/amt-5-2201-2012.
- D. Bhavana, M. A. Sumesh, S. P. Karanth: A compact UV sensor for vertical ozone profiling by solar occultation. In: Journal of Atmospheric and Solar-Terrestrial Physics. 240, 2022, S. 105962, doi:10.1016/j.jastp.2022.105962.
- E. Kyrölä u. a.: GOMOS on Envisat: an overview. In: Advances in Space Research. 33.7, 2004, S. 1020–1028, doi:10.1016/s0273-1177(03)00590-8.
- TOMS (Total Ozone Mapping Spectrometer) - eoPortal. In: eoportal.org. 18. Juni 2012, abgerufen am 1. März 2024 (englisch).
- J. P. Veefkind u. a.: Total ozone from the ozone monitoring instrument (OMI) using the DOAS technique. In: IEEE Transactions on Geoscience and Remote Sensing. 44.5, 2006, S. 1239–1244, doi:10.1109/tgrs.2006.871204.
- ESA: ESA - About GOME-2. In: esa.int. Abgerufen am 12. März 2024 (englisch).
