Orthoester
Orthoester (genauer: Orthocarbonsäureester) mit der allgemeinen Formel R–C(OR’)3 sind dreifache Ester der in freier Form nicht existenten Orthocarbonsäuren [R–C(OH)3], den Additionsprodukten von Wasser an Carbonsäuren (Hydrate). Orthocarbonsäuren folgen der Erlenmeyer-Regel; das Gleichgewicht der Addition von Wasser liegt jeweils deutlich auf der Seite der Carbonsäure.
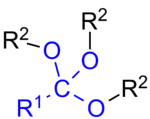
_General_Formulae_V.1.png.webp)
Beispiele für Orthoester sind Orthoameisensäuretrimethylester HC(OCH3)3, Orthoameisensäuretriethylester HC(OCH2CH3)3, Orthoessigsäuretriethylester CH3C(OCH2CH3)3, sowie Mezerein oder Daphnetoxin (zwei Orthoester der Benzoesäure). Im Tetrodotoxin liegt das Strukturelement eines Orthocarbonsäuredialkylesters als Anion vor.
Weitere kohlenstoffhaltige Orthoester sind Orthokohlensäureester, vierfache Ester der ebenfalls instabilen Orthokohlensäure C(OH)4, etwa Orthokohlensäuretetramethylester.
Darstellung
Die Herstellung von Orthoestern kann durch die Reaktion von Nitrilen mit Alkoholen unter Säurekatalyse durchgeführt werden:
- RCN + 3 R’OH → R–C(OR’)3 + NH3
Die Orthoameisensäureester sind durch eine Williamson-Ethersynthese aus Chloroform und den Natrium-Alkoholaten der entsprechenden Alkohole zugänglich.[1]
In schwach sauren wässrigen Lösungen entstehen aus einem Orthoester ein Carbonsäureester und ein Alkohol:
- R–C(OR’)3 + H2O → R–CO–O–R’ + 2 R’OH
Verwendung und Eigenschaften
Orthoester werden in der organischen Synthese als Schutzgruppen für Carbonsäuren genutzt. Die Reaktion von Orthoestern mit Ketonen liefert Ketale und Carbonsäureester.[2] Weiterhin eignen sie sich zum Entfernen von Wasser, z. B. aus Reaktionsgemischen.[3]
Auch anorganische Säuren können Orthoester bilden, so die Orthokohlensäureester und die Orthokieselsäureester.
Orthoester sind chemisch verwandt mit Carbonsäureestern, Ethern und Acetalen.
Einzelnachweise
- W. E. Kaufmann, E. E. Dreger: Ethyl orthoformate In: Organic Syntheses. 5, 1925, S. 55, doi:10.15227/orgsyn.005.0055; Coll. Vol. 1, 1941, S. 258 (PDF).
- Ivan Ernest: Bindung, Struktur und Reaktionsmechanismen in der organischen Chemie, Springer-Verlag, 1972, ISBN 3-211-81060-9, S. 193.
- Eintrag zu Orthoester. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juni 2014.