Orientin
Orientin ist ein natürlich vorkommendes, glycosiliertes Flavonoid, genauer ein glycosiliertes Flavon. Als isolierte Substanz liegt es in der Form eines gelben Feststoffs vor.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
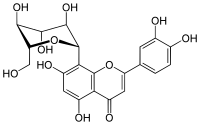 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Orientin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C21H20O11 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 448,383 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen
Orientin kommt in vielen verschiedenen Pflanzen, darunter dem Mönchspfeffer (Vitex agnus-castus),[5] dem Tamarindenbaum (Tamarindus indica),[5] dem Gemeinem Lein (Linum usitatissimum),[5] dem Hanf (Cannabis sativa),[5] dem Buchweizen (Fagopyrum esculentum),[5] der Amerikanischen Heidelbeere (Vaccinium corymbosum),[5] der Passionsblume (Passiflora incarnata),[6][5] Rooibos,[7] einigen Bambussorten,[8][9] Gerste (Hordeum vulgare)[5] und der Japanischen Sumpf-Schwertlilie[3], vor.
 Blaue Passionsblume
Blaue Passionsblume Mönchspfeffer
Mönchspfeffer.JPG.webp) Hanf
Hanf Gerste
Gerste
Biologische Wirkung
Orientin besitzt eine antioxidative Wirkung.[10] Im Tierversuch wirkt es außerdem entzündungshemmend.[2]
Isomere
Das Regioisomer Isoorientin ist ebenfalls als Naturprodukt in verschiedenen Pflanzen, darunter Bambus[9] und Passionsfrucht,[11] vorhanden.
Einzelnachweise
- Datenblatt Orientin (PDF) bei Carl Roth, abgerufen am 23. Oktober 2021.
- V. C. da Silva, P. T. de Sousa Jr., E. L. Dall'oglio, G. E. Matiz, M. G. de Carvalho: Anti-inflammatory activities of flavonoids from Luxemburgia octandra flowers. In: Chemistry of Natural Compounds. Band 46, Nr. 6, 2011, S. 961–963, doi:10.1007/s10600-011-9796-5.
- N. I. Pryakhina, K. F. Blinova: Luteolin C-glycosides from Iris ensata. In: Chemistry of Natural Compounds. Band 20, Nr. 1, 1084, S. 107.
- Datenblatt Orientin bei Sigma-Aldrich, abgerufen am 23. Oktober 2021 (PDF).
- ORIENTIN (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 18. Juli 2021.
- E. R. Pastene, G. Bocaz, I. Peric, M. Montes, V. Silva, E. Riffo: Separation by capillary electrophoresis of C-glycosylflavonoids in Passiflora sp. extracts. In: Boletín de la Sociedad Chilena de Química. Band 45, Nr. 3, 2000, S. 461–467, doi:10.4067/S0366-16442000000300017.
- Astrid von Gadow, Elizabeth Joubert, Chris F. Hansmann: Comparison of the Antioxidant Activity of Aspalathin with That of Other Plant Phenols of Rooibos Tea (Aspalathus linearis), α-Tocopherol, BHT, and BHA. In: Journal of Agricultural and Food Chemistry. Band 45, Nr. 3, 1997, S. 632–638, doi:10.1021/jf960281n.
- Yu Zhanga, Jingjing Jiaoa, Chengmei Liub, Xiaoqin Wua, Ying Zhang: Isolation and purification of four flavone C-glycosides from antioxidant of bamboo leaves by macroporous resin column chromatography and preparative high-performance liquid chromatography. In: Food Chemistry. Band 107, Nr. 3, 2008, S. 1326–1336, doi:10.1016/j.foodchem.2007.09.037.
- Wang, Jin; Tang, Feng; Yue, Yongde; Guo, Xuefeng; Yao, Xi: Development and validation of an HPTLC method for simultaneous quantitation of isoorientin, isovitexin, orientin, and vitexin in bamboo-leaf flavonoids. In: Journal of AOAC International. Band 93, Nr. 5, 2010, S. 1376–1383 (ingentaconnect.com).
- Nan Wu, Kuang Fu, Yu-Jie Fu, Yuan-Gang Zu, Fang-Rong Chang, Yung-Husan Chen, Xiao-Lei Liu, Yu Kong, Wei Liu, Cheng-Bo Gu: Antioxidant Activities of Extracts and Main Components of Pigeonpea [Cajanus cajan (L.) Millsp.] Leaves. In: Molecules. Band 14, Nr. 3, 2009, S. 1032–1043, doi:10.3390/molecules14031032.
- M.L. Zeraik, J.H. Yariwake: Quantification of isoorientin and total flavonoids in Passiflora edulis fruit pulp by HPLC-UV/DAD. In: Microchemical Journal. Band 96, Nr. 1, 2010, S. 86–91, doi:10.1016/j.microc.2010.02.003.