Olivetolsäure
Olivetolsäure, auch 4-Hydroxy-6-n-pentylsalicylsäure, ist das Carbonsäure-Derivat von Olivetol. Es ist ein Meroterpenoid das als biogenetischer Vorläufer verschiedener Derivate des Dibenzopyrans – der sogenannten Cannabinoide – dient.[3] Durch enzymatische Kondensation aus den beiden Präkursoren Geranylpyrophosphat und Olivetolsäure wird Cannabigerolsäure gebildet, die anschließend enzymatisch in Tetrahydrocannabinolsäure umgelagert wird.[4] Olivetolsäure selbst wird wahrscheinlich auf analogem Weg wie die Orsellinsäure synthetisiert und zwar ausgehend von einem Tetraketid, das aus Capronsäure und drei Acetat-Einheiten gebildet wird.[3][5][6] Olivetolsäure kann auch künstlich dargestellt werden.[7] In einer neueren Publikation werden spezielle Amöben zur Synthese der Olivetolsäure eingesetzt.[8] Olivetolsäure kommt natürlich in dem Pilz Cetrelia sanguinea vor und besitzt eine monokline Kristallstruktur mit der Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2).[9]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
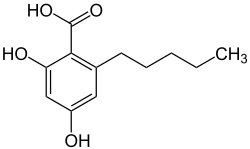 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Olivetolsäure | ||||||||||||
| Andere Namen |
4-Hydroxy-6-n-pentylsalicylsäure | ||||||||||||
| Summenformel | C12H16O4 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 224,25 g·mol−1 | ||||||||||||
| Schmelzpunkt |
148–149 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Von der Orsellinsäure unterscheidet es sich in der Länge der Alkylseitenkette. Durch Decarboxylierung entsteht das Olivetol.
Einzelnachweise
- M.P. Polovinka; N.I. Komarova; D.V. Korchagina; D.N. Sokolov; O.A. Luzina; N.G. Vlasenko; A.A. Malyuga; E.V. Romanova; N.F. Salakhutdinov: Secondary metabolites of the lichen Cladonia stellaris in Chemistry of Natural Compounds 48 (2012) 392–395, doi:10.1007/s10600-012-0259-4.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle eine Einführung in die organische Chemie. John Wiley & Sons, 2006, ISBN 3-906390-29-2, S. 420 (eingeschränkte Vorschau in der Google-Buchsuche).
- J. Jung, M. R. Meyer, H. H. Maurer, C. Neusüß, W. Weinmann, V. Auwärter: Studies on the metabolism of the Δ9-tetrahydrocannabinol precursor Δ9-tetrahydrocannabinolic acid A (Δ9-THCA-A) in rat using LC-MS/MS, LC-QTOF MS and GC-MS techniques. In: Journal of Mass Spectrometry. Band 44, Nr. 10, 2009, S. 1423–1433, doi:10.1002/jms.1624.
- Breitmaier, Eberhard et al.: Organische Chemie, 2012, Kap. 45: Biosynthese der Naturstoffe, 45.6 Polyketide, doi:10.1055/b-0034-44145.
- Comprehensive Natural Products II: Chemistry and Biology. Newnes, 2010, ISBN 0-08-045382-1, S. 192 (eingeschränkte Vorschau in der Google-Buchsuche).
- A. Chittiboyina, I. A. Khan: Short Synthesis of Olivetolic Acid via Directed ortho-Metalation (DoM). In: Planta Medica. 78, 2012, doi:10.1055/s-0032-1307550.
- Polyketide aus Amöben
- Friardi Ismed, Aulia Farhan, Amri Bakhtiar, Erizal Zaini, Yuda Prasetya Nugraha, Okky Dwichandra Putra, Hidehiro Uekusa: Crystal structure of olivetolic acid: a natural product from (Schaer.). In: Acta Crystallographica Section E Crystallographic Communications. 72, 2016, S. 1587, doi:10.1107/S2056989016016273.