Octafluorcyclobutan
Octafluorcyclobutan ist eine chemische Verbindung aus der Gruppe der organischen Fluorverbindungen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
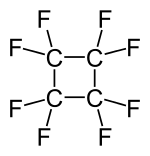 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Octafluorocyclobutan (INN) | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4F8 | |||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit etherischem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 200 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−6,4 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
sehr schlecht in Wasser (140 mg·l−1)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Treibhauspotential |
10592 (bezogen auf 100 Jahre)[3] | |||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−1542,6 kJ/mol[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Herstellung
Durch volle Fluorierung von Cyclobutan mit elementarem Fluor über radikalische Substitution (für genaueres siehe Trichlormethan) lässt sich die Perfluorverbindung herstellen:
Eigenschaften
Octafluorcyclobutan ist ein farbloses nicht brennbares Gas mit etherischem Geruch, welches geringfügig löslich in Wasser ist. Industriell wird es in Form von Druckgasflaschen geliefert, in denen es in verflüssigter Form vorliegt. Beim Ausströmen der Flüssigkeit oder beim Entweichen großer Gasmengen bilden sich kalte Nebel, die sich am Boden ausbreiten. Bei hohen Konzentrationen besteht Erstickungsgefahr. Seine kritische Temperatur liegt bei 115,32 °C, der kritische Druck bei 27,8 bar, die kritische Dichte bei 0,62 kg/l, die Tripelpunkt-Temperatur bei −40,2 °C und der Tripelpunkt-Druck bei 0,191 bar.[2]
Verwendung
Octafluorcyclobutan wird in der Halbleitertechnik als Ätz- und Passivierungsgas verwendet (vgl. Reaktives Ionentiefenätzen). Weiters wird Octafluorcyclobutan wegen seiner hohen Durchschlagsfestigkeit, diese ist bei Normaldruck um ca. 25 % höher als bei dem in gasisolierten Schaltanlagen eingesetzten Schwefelhexafluorid (SF6), auch in der Hochspannungstechnik als Isoliergas eingesetzt.[5]
Ökologische Aspekte
Octafluorcyclobutan ist ein starkes und extrem langlebiges Treibhausgas mit einer atmosphärischen Verweildauer von 1400 bis 3200 Jahren. 2019 wurde bekannt, dass die tatsächlichen Emissionen einiger Staaten deutlich größer sind als die nach Pariser Klimaschutzabkommen gemeldeten. Neben Indien und Russland wurden erhöhte Emissionen insbesondere in China nachgewiesen. Es wird vermutet, dass die Emissionen im Zusammenhang mit der Teflonproduktion stehen.[6]
Einzelnachweise
- Praxair: Sicherheitsdatenblatt Octafluorcyclobutan.
- Eintrag zu CAS-Nr. 115-25-3 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Mai 2011. (JavaScript erforderlich)
- G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- M.S. Naidu, V. Kamaraju: High Voltage Engineering. 2. Auflage. McGraw-Hill Professional, 1995, ISBN 978-0-07-136108-8.
- Mühle, J., Trudinger, C. M. et al.: Perfluorocyclobutane (PFC-318, c-C4F8) in the global atmosphere, Atmospheric Chemistry and Physics, 19, 2019, S. 10335–10359, doi:10.5194/acp-19-10335-2019.
