Nerol
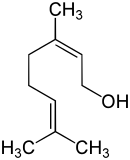
Nerol (nach IUPAC (Z)-2,6-Dimethyl-2,6-octadien-8-ol genannt) ist ein acyclischer Monoterpen-Alkohol. Die klare Flüssigkeit hat einen frischen, süßen, rosig-zitrusartigen Geruch. Nerol ist isomer zum Geraniol. Der Stoff hat seinen Namen durch das Vorkommen in Neroliöl.[7]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Nerol | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C10H18O | |||||||||||||||
| Kurzbeschreibung |
farblose, Flüssigkeit mit charakteristischem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 154,25 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,88 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
224–225 °C[4] | |||||||||||||||
| Brechungsindex |
1,474 (20 °C)[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Struktur
Geraniol ist das trans-Isomer, Nerol das cis-Isomer der Verbindung mit derselben Summenformel. Es ist ein primärer, einwertiger Alkohol: Das Molekül weist eine Hydroxygruppe auf, an das Kohlenstoffatom, an das diese Hydroxygruppe gebunden ist, ist direkt nur ein weiteres Kohlenstoffatom gebunden.
Vorkommen


Nerol kommt in vielen ätherischen Ölen wie von Wermut,[8] Estragon (Artemisia dracunculus),[9] Echter Katzenminze (Nepeta cataria),[9] Zitronen (Citrus limon),[9] Basilikum (Ocimum basilicum),[9] Echtem Koriander (Coriandrum sativum),[9] Grünem Kardamom (Elettaria cardamomum),[9] Polei-Minze (Mentha pulegium),[9] Muskatnuss (Myristica fragrans),[9] Schwarzem Holunder (Sambucus nigra),[9] Lavendel oder Rosen vor. Es kommt immer gemeinsam mit Geraniol vor.[10][7]
Herstellung
Nerol fällt als Nebenprodukt bei der Herstellung von Geraniol an und wird hauptsächlich auf diese Weise gewonnen.[10] Eine gezielte Darstellung gelingt durch die Telomerisation von Isopren mit Butyllithium in Gegenwart von Dipropylamin. Das entstehende N,N-Dipropylnerylamin wird in weiteren Schritten mit hoher Selektivität zum Nerol umgesetzt.[11]
Eigenschaften
Der Flammpunkt liegt bei 100 °C. In einem Liter Wasser sind weniger als ein Gramm Nerol löslich. An der Luft wird Nerol zu Neroloxid oxidiert. Nerol ist gesundheitsschädlich.
Verwendung
Es wird zu Herstellung von Citral, Citronellol, Vitamin A und Vitamin E benötigt. Nerol wird in der Parfümerie in Rosen-, Blütenduft- aber auch Citrus-Kompositionen als Duftstoff verwendet.[7]
Einzelnachweise
- Eintrag zu NEROL in der CosIng-Datenbank der EU-Kommission, abgerufen am 1. November 2021.
- Datenblatt Nerol (PDF) bei Carl Roth, abgerufen am 14. Dezember 2010.
- Datenblatt Nerol bei Alfa Aesar, abgerufen am 14. Dezember 2010 (Seite nicht mehr abrufbar).
- Eintrag zu Geraniole. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. November 2014.
- Datenblatt Nerol bei Sigma-Aldrich, abgerufen am 15. April 2011 (PDF).
- Eintrag zu Nerol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- Karl‐Georg Fahlbusch, Franz‐Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe, Horst Surburg: Flavors and Fragrances. In: Ullmann’s Encyclopedia of Industrial Chemistry. Band 15, 2012, S. 86, doi:10.1002/14356007.a11_141.
- Otto Vostrowsky, Thorolf Brosche, Helmut Ihm, Robert Zintl, Karl Knobloch: Über die Komponenten des ätherischen Öls aus Artemisia absinthium L.. In: Zeitschrift für Naturforschung C. 36, 1981, S. 369–377 (PDF, freier Volltext).
- NEROL (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 15. August 2021.
- Horst Surburg & Johannes Panten: Common Fragrance and Flavor Materials. 6. Vollständig überarbeitete und erweiterte Auflage. Wiley-VCH, 2016, ISBN 978-3-527-33160-4, S. 32.
- Kunihiko Takabe, Takao Katagiri, Juntaro Tanaka: Highly stereoselective syntheses of nerol and geraniol. In: Chemistry Letters. 6.9, 1977, S. 1025–1026.
