Neohesperidin
Neohesperidin ist ein bitter schmeckender Stoff aus der Gruppe der Flavanone, es ist ein Glycosid von Hesperetin. Natürlich kommt es in Bitterorangen und in Grapefruits vor.[3]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Neohesperidin | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C28H34O15 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 610,6 g·mol−1 | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Verwendung
Durch Hydrierung von Neohesperidin ist Neohesperidin-Dihydrochalkon, ein hochintensiver Süßstoff, zugänglich.[4]
Vorkommen
Neohesperidin kommt in Bitterorangen, Tangelos (Kreuzung aus Grapefruit und Mandarine) und in Grapefruits vor.[5] Der Gehalt an Neohesperidin hängt dabei vom Reifegrad der Frucht und der Züchtung der Citrus-Art ab.[6] So gibt es Cultivars der Tangelos, die keinerlei Neohesperidin enthalten, andere hingegen enthalten vergleichsweise viel Neohesperidin. Beispielsweise die K-Early, ein Tangelo-Cultivar, enthält mit 720 ppmvergleichsweise viel Neohesperidin in seinem Fruchtsaft. Neohesperidin kommt in ganz unterschiedlichen Bereichen der Früchte vor. So kann es im Saft der Frucht, aber auch in den Schalen und in den Blüten bzw. den Fruchtknoten und Fruchtnarben gefunden werden.[5][6]
Isolierung
Eine Möglichkeit Neohesperidin zu isolieren besteht darin, es aus zermahlenen Bitterorangenblüten mit 96-prozentigem Alkohol zu extrahieren. Nach Auskochen der zermahlenen Blüten, Einengen der Lösung und mehrtägigem Stehen bei Raumtemperatur fällt Neohesperidin aus.[6]
Struktur
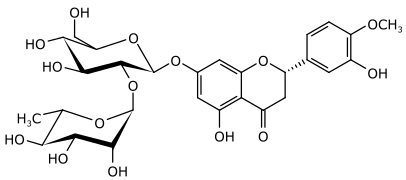
Als Vertreter der Flavonoide, einer Untergruppe der phenolischen Pflanzenstoffe, besteht Neohesperidin aus einem Flavanonteil, welcher über eine glycosidische Bindung an das Glykon Neohesperidose (ein Disaccharid) gebunden ist.[7] Hierbei ist das für Flavonoide charakteristische Phenylpropangerüst zu erkennen, welches einen weiteren aromatischen Ring trägt. Durch einen intramolekularen Ringschluss wird die Chalkonform in die Flavanonform umgewandelt.[8] Das im Neohesperdin vorliegende Flavanon wird Hesperetin genannt, es ist auch im strukturverwandten Hesperidin enthalten.[7] Dieses sogenannte Hesperetin-Aglykon ist an seinem C-7 Atom an das Glykon gebunden.[9] Aus der Struktur ergibt sich, dass Neohesperidin elf Stereozentren besitzt und somit optisch aktiv ist. Neben den zehn stereogenen Zentren der Glykosidkomponente enthält auch das Hesperetin ein asymmetrisches Kohlenstoffzentrum. Dieses C-2 Atom weist hierbei in der natürlichen Form die (S)-Konfiguration auf.[10]
Synthese
Aufgrund der hohen Nachfrage nach Neohesperidin, unter anderem aufgrund seiner Verwendung zur Herstellung des Süßstoffes Neohesperidin-Dihydrochalkon, aber auch aufgrund der interessanten pharmazeutischen Eigenschaften, sind diverse Syntheseverfahren entwickelt worden. Als Ausgangsstoff kann beispielsweise das leichter verfügbare Naringin verwendet werden, welches in alkalischer Umgebung zerfällt und anschließend mit Isovanillin zum Neohesperidin umgesetzt werden kann. Die hierbei patentierten Verfahren unterscheiden sich größtenteils in der Wahl des Katalysators, wobei häufig sekundäre Amine für diesen Zweck eingesetzt werden.[11] Im Jahr 1967 veröffentlichten Kamiya, Esaki und Hama einen Syntheseweg, welcher Neohesperidin aus den Grundbausteinen α-L-Rhamnose, β-D-Glucose, 2,4,5-Trihydroxyacetophenon und Isovanillin zugänglich macht. Hierbei wird auch das Flavanongrundgerüst neu synthetisiert. Zunächst werden α-Acetobrom-L-Rhamnose[12] und 1,3,4,6-Tetra-O-acetyl-α-D-glucopyranose in einer Kondensationsreaktion zur acetylierten Neohesperidose umgesetzt. Diese wird anschließend über eine nucleophile Substitutionsreaktion mit einer gesättigten Lösung von Bromwasserstoff in Essigsäure bei 0 °C am C-1 Atom der Glucose bromiert. Das Disaccharid kann nun in einer Kondensationsreaktion unter Deacetylierung mit 2,4,5-Trihydroxyacetophenon unter dem Zusatz von Ag2O und Chinolin reagieren. Im Anschluss erfolgt eine Aldolkondensation mit Isovanillin in 60%iger Kaliumhydroxidlösung in Ethanol. Nach Ansäuern mit HClO4 wird das Neohesperidinchalkon erhalten. Dieses wird mit Pufferlösung (pH = 6) gekocht, wobei über einen Ringschluss die Flavanonform, das Neohesperidin, entsteht.[13] Da dieser Ringschluss nicht stereoselektiv erfolgt, werden zwei Epimere erhalten, die sich in ihrer Konfiguration am C-2 Atom des Hesperetin-Aglucons unterscheiden. Aufgrund dieser Problematik wurde in den letzten Jahren intensiv an stereospezifischen Syntheserouten für Flavanone geforscht und Methoden entwickelt, die die Ausbeute an enantiomerenreinen Flavanonen erhöhen sollen.[14]
Biologische Wirkung
Neohesperidin ist ein Antioxidans und kann als Radikalfänger dienen.[15] Außerdem wirkt es entzündungshemmend. Vielfältige therapeutische Wirkungen werden untersucht, jedoch befinden sich diese meist noch in der Entwicklung. Beispielsweise wurde in Tierversuchen von einer die Knochengesundheit fördernden Wirkung berichtet.[16] Auch in der Krebstherapie könnte Neohesperidin eine Wirkung besitzen. So wurde bei kultivierten Brustkrebszellen beobachtet, dass die Gabe von Neohesperidin zu einer erhöhten Apoptoserate führte.[17] Auch ein Veränderung der Darmflora durch Neohesperidingabe wurde in Tierversuchen beobachtet. Diese führte bei mit sehr fetthaltiger Nahrung gefütterten Mäusen zu einer Abschwächung der Gewichtszunahme, der Insulinresistenz und der Entzündlichkeit.[18] In einem anderen Tierversuch konnte eine Verringerung der Darmtumorrate beobachtet werden, die möglicherweise ebenfalls auf eine veränderte Darmflora zurückgeführt werden kann.[19]
Bei Menschen mit leicht erhöhtem Cholesterinspiegel konnte bei Gabe des Bergamotte-Saft-Extrakts Bergavit eine Senkung der Blutfettwerte, der LDL sowie von Markern für subklinische Atherosklerose beobachtet werden. Dieses Extrakt beinhaltet neben Neohesperidin noch weitere Flavonoide wie Neoeriocitrin und Naringin.[20]
Einzelnachweise
- Eintrag zu NEOHESPERIDIN in der CosIng-Datenbank der EU-Kommission, abgerufen am 22. Oktober 2021.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Eintrag zu Hesperetin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Juli 2022.
- Eintrag zu Neohesperidin-Dihydrochalkon. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Juli 2022.
- Russell L. Rouseff, Shirley F. Martin, and Charles 0. Youtsey: Quantitative Survey of Narirutin, Naringin, Hesperidin, and Neohesperidin in Citrus. Hrsg.: J. Agric. Food Chem. Band 35, 1987, S. 1027–1030.
- W.Karrer: Uber das Vorkommen von Hesperidin und Neohesperidin in unreifen Pomeranzen und in den Fruchtknoten und Narben der Pomeranzen-Blüten. Hrsg.: Helvetica Chimica Acta. Band 94, 1949, S. 714–717.
- F. Kolle, K. E. Gloppe: Ein neues Hesperidin. In: Prof. Dr. K. H. Bauer (Hrsg.): Pharmazeutische Zentralhalle für Deutschland. Band 77, Nr. 28, 1936, S. 421–425.
- H.-W. Heldt, B. Piechulla, F. Heldt: Pflanzenbiochemie. 5. Auflage. Springer Spektrum, Berlin Heidelberg 2015, ISBN 978-3-662-44397-2.
- R.M. Horowitz, Bruno Gentili: Flavonoids of citrus—VI. In: Tetrahedron. Band 19, Nr. 5, Januar 1963, S. 773–782, doi:10.1016/S0040-4020(01)99211-7.
- E. Hardegger, H. Braunschweiger: Die absolute Konfiguration des Aglucons im Neohesperidin. In: Helvetica Chimica Acta. Band 44, Nr. 5, 1961, S. 1413–1417, doi:10.1002/hlca.19610440528.
- Patent CN114478657A: Synthesis method of neohesperidin. Angemeldet am 18. Februar 2022, veröffentlicht am 13. Mai 2022, Anmelder: UNIV XIAMEN, Erfinder: LI SIFANG; ZHONG YIQIONG.
- Externe Identifikatoren von bzw. Datenbank-Links zu 2,3,4-Tri-O-acetyl-α-L-rhamnopyranosylbromid: CAS-Nummer: 5158-64-5, PubChem: 11131940, ChemSpider: 9307059, Wikidata: Q120675058.
- S. Kamiya, S. Esaki, M. Hama: Glycosides and Oligosaccharides in the L-Rhamnose Series - Part IV Synthesis of Naringin and Neohesperidin. In: Agricultural and Biological Chemistry. Band 31, Nr. 4, 1967, S. 402–409.
- A. E. Nibbs, K. A. Scheidt: Asymmetric Methods for the Synthesis of Flavanones, Chromanones, and Azaflavanones. In: European Journal of Organic Chemistry. Band 2012, Nr. 3, Januar 2012, S. 449–462, doi:10.1002/ejoc.201101228.
- Sam-Long Hwang, Gow-Chin Yen: Neuroprotective Effects of the Citrus Flavanones against H 2 O 2 -Induced Cytotoxicity in PC12 Cells. In: Journal of Agricultural and Food Chemistry. Band 56, Nr. 3, Februar 2008, S. 859–864, doi:10.1021/jf072826r.
- Adriana de Cássia Ortiz, Simone Ortiz Moura Fideles, Carlos Henrique Bertoni Reis, Márcia Zilioli Bellini, Eliana de Souza Bastos Mazuqueli Pereira, João Paulo Galletti Pilon, Miguel Ângelo de Marchi, Cláudia Rucco Penteado Detregiachi, Uri Adrian Prync Flato, Beatriz Flavia de Moraes Trazzi, Bruna Trazzi Pagani, José Burgos Ponce, Taiane Priscila Gardizani, Fulvia de Souza Veronez, Daniela Vieira Buchaim, Rogerio Leone Buchaim: Therapeutic Effects of Citrus Flavonoids Neohesperidin, Hesperidin and Its Aglycone, Hesperetin on Bone Health. In: Biomolecules. Band 12, Nr. 5, Mai 2022, S. 626, doi:10.3390/biom12050626, PMID 35625554, PMC 9138288 (freier Volltext).
- Fei Xu, Jia Zang, Daozhen Chen, Ting Zhang, Huiying Zhan, Mudan Lu, Hongxiang Zhuge: Neohesperidin Induces Cellular Apoptosis in Human Breast Adenocarcinoma MDA-MB-231 Cells via Activating the Bcl-2/Bax-mediated Signaling Pathway. In: Natural Product Communications. Band 7, Nr. 11, November 2012, S. 1934578X1200701, doi:10.1177/1934578X1200701116.
- Jun Feng Lu, Meng Qing Zhu, Heng Zhang, Hao Liu, Bo Xia, Yong Liang Wang, Xin’e Shi, Liang Peng, Jiang Wei Wu: Neohesperidin attenuates obesity by altering the composition of the gut microbiota in high‐fat diet‐fed mice. In: The FASEB Journal. Band 34, Nr. 9, September 2020, S. 12053–12071, doi:10.1096/fj.201903102RR.
- Yanling Gong, Rong Dong, Xiaomeng Gao, Jin Li, Li Jiang, Jiale Zheng, Sunliang Cui, Meidan Ying, Bo Yang, Ji Cao, Qiaojun He: Neohesperidin prevents colorectal tumorigenesis by altering the gut microbiota. In: Pharmacological Research. Band 148, Oktober 2019, S. 104460, doi:10.1016/j.phrs.2019.104460.
- Peter P. Toth, Angelo M. Patti, Dragana Nikolic, Rosaria V. Giglio, Giuseppa Castellino, Teresa Biancucci, Fabiana Geraci, Sabrina David, Giuseppe Montalto, Ali Rizvi, Manfredi Rizzo: Bergamot Reduces Plasma Lipids, Atherogenic Small Dense LDL, and Subclinical Atherosclerosis in Subjects with Moderate Hypercholesterolemia: A 6 Months Prospective Study. In: Frontiers in Pharmacology. Band 6, 6. Januar 2016, doi:10.3389/fphar.2015.00299, PMID 26779019, PMC 4702027 (freier Volltext).