Neodym(III)-chlorid
Neodym(III)-chlorid ist eine chemische Verbindung aus der Gruppe der Chloride. Zu beachten ist, dass es im Phasendiagramm von Neodym und Chlor zwischen Neodym(II)-chlorid NdCl2 und Neodym(III)-chlorid NdCl3, mit NdCl2,25 und NdCl2,36 zwei weitere nachgewiesene Phasen gibt.[6]
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
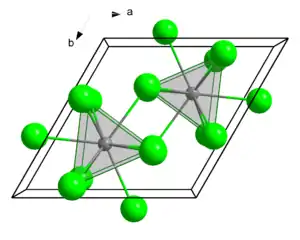 | ||||||||||
| _ Nd3+ _ Cl− | ||||||||||
| Kristallsystem | ||||||||||
| Raumgruppe |
P63/m (Nr. 176) | |||||||||
| Koordinationszahlen |
Nd[9], Cl[3] | |||||||||
| Allgemeines | ||||||||||
| Name | Neodym(III)-chlorid | |||||||||
| Andere Namen |
| |||||||||
| Verhältnisformel | NdCl3 | |||||||||
| Kurzbeschreibung |
rosafarbenes Pulver[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 250,60 g·mol−1 | |||||||||
| Aggregatzustand |
fest[2] | |||||||||
| Dichte |
4,134 g·cm−3 (25 °C)[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
1600 °C[4] | |||||||||
| Löslichkeit |
löslich in Wasser[5] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
Neodym(III)-chlorid kann durch Reaktion von Neodym(III)-oxid mit Chlorwasserstoff oder Ammoniumchlorid gewonnen werden.[7]
Es kann auch direkt aus den Elementen synthetisiert werden.[8]
Eine weitere Methode läuft über eine Reaktion mit Aluminiumchlorid bei 175 °C in einer ionischen Flüssigkeit.[9]
Eigenschaften

Neodym(III)-chlorid ist ein rosafarbenes bis blassviolettes stark hygroskopisches Pulver, das an Luft schnell Feuchtigkeit aufnimmt und sich in das Hexahydrat umwandelt.[10] Es besitzt eine hexagonale Kristallstruktur mit der Raumgruppe P63/m (Raumgruppen-Nr. 176). Das Hexahydrat ist violett und besitzt eine monokline Kristallstruktur mit der Raumgruppe P2/c (Nr. 13). Bei 160 °C gibt es das Kristallwasser ab und bildet die wasserfreie Form.[1]
Verwendung
Neodym(III)-chlorid wird als Laborchemikalie und zur Herstellung von anderen Neodymverbindungen verwendet.[2] Es dient auch als Katalysator bei organischen Synthesen.[11] Das Hexahydrat wird vor allem für Glas, Kristall und Kondensatoren verwendet. Farbiges Glas mit Zusätzen aus Neodymchlorid zeigt zarte Schattierungen von Violett über reines Weinrot und zu warmem Grau. Diese Gläser zeigen ungewöhnlich scharfe Absorptionsbanden.[5]
Einzelnachweise
- Jean D’Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 2007, ISBN 978-3-540-60035-0, S. 634 (eingeschränkte Vorschau in der Google-Buchsuche).
- Datenblatt Neodymium(III) chloride, anhydrous, powder, ≥99.99% trace metals basis bei Sigma-Aldrich, abgerufen am 24. April 2012 (PDF).
- Datenblatt Neodymium(III) chloride hexahydrate, 99.99% bei Sigma-Aldrich, abgerufen am 24. April 2012 (PDF).
- Webelements: Neodymium trichloride
- Neodymium Chloride
- G. Meyer, Lester R. Morss: Synthesis of Lanthanide and Actinide Compounds. Springer, 1991, ISBN 0-7923-1018-7, S. 161 (eingeschränkte Vorschau in der Google-Buchsuche).
- Pradyot Patnaik: Handbook of Inorganic Chemicals. McGraw-Hill, 2003, ISBN 978-0-07-049439-8, S. 243 (eingeschränkte Vorschau in der Google-Buchsuche).
- Webelements: Reaction of neodymium with the halogens
- Sameera Shah, Tobias Pietsch und Michael Ruck: Facile Synthesis of Anhydrous Rare-Earth Trichlorides from their Oxides in Chloridoaluminate Ionic Liquids. In: Angew. Chem.Int. Ed. Band 63, 2024, S. e20231748, doi:10.1002/anie.202317480.
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1079.
- O. Nuyken, Reiner Anwander: Neodymium Based Ziegler Catalysts. Springer, 2006, ISBN 978-3-540-34809-2, S. 15 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
